题目内容
碳酸铵[(NH4)2CO3]室温下能自发地分解产生氨气,对其说法正确的是( )
| A、碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大 |
| B、碳酸铵分解是因为外界给予了能量 |
| C、该反应的△H-T△S>0 |
| D、碳酸盐都不稳定,都能自发分解 |
考点:铵盐
专题:氮族元素
分析:碳酸铵室温下自发地分解生成氨气,发生反应的化学方程式为(NH4)2CO3=NH3↑+CO2↑+H2O,反应生成了气体氨气和二氧化碳,所以熵变增大;反应自发进行的判断依据是△H-T△S<0,自发进行,△H-T△S>0反应不能自发进行,△H-T△S=0反应达到平衡.
解答:
解:A、碳铵自发分解,是因为体系由于氨气和二氧化碳气体的生成而使熵增大,故A正确;
B、碳酸铵在室温下就能自发地分解,不需要外界给予了能量,故B错误;
C、反应自发进行,即该反应的△H-T△S<0,故C错误;
D、有的碳酸盐稳定,不能自发分解,如Na2CO3受热不分解,故D错误;
故选A.
B、碳酸铵在室温下就能自发地分解,不需要外界给予了能量,故B错误;
C、反应自发进行,即该反应的△H-T△S<0,故C错误;
D、有的碳酸盐稳定,不能自发分解,如Na2CO3受热不分解,故D错误;
故选A.
点评:本题考查了反应自发进行的判断依据是由焓变和熵变共同决定的,主要是焓变和熵变含义的应用.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA |
| B、0.1 mol?L-1的Na2CO3溶液中Na+数为0.1NA |
| C、若一筒120g的墨粉能打a个字,则平均每个字约含有10NA个碳原子 |
| D、0.5mol的甲基(-CH3)与氢氧根(OH-)所含电子数都为5NA |
A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是:( )
| 物质 编号 | 物质转化关系 | A | D | E |
| ① | 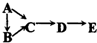 | Si | SiO2 | H2SiO3 |
| ② | N | NO2 | HNO3 | |
| ③ | S | SO2 | H2SO4 | |
| ④ | Na | Na2O2 | NaOH |
| A、①②③④ | B、②③ |
| C、①③④ | D、②④ |
一定能在下列溶液中大量共存的离子组是( )
| A、水电离产生的c(H+)=1×10-12mol?L-1溶液:NH4+、Na+、Cl-、NO3- |
| B、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
| C、含有大量Fe3+的溶液:SCN-、I-、K+、Br- |
| D、酸性溶液中:Cl-、MnO4-、Al3+、SO42- |
下列离子方程式正确的是( )
| A、铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、铜跟稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| C、硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| D、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O |
已知:

则符合要求的C5H10O2的结构有( )

则符合要求的C5H10O2的结构有( )
| A、1种 | B、2种 | C、4种 | D、5种 |