题目内容
设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A、常温常压下,11.2L氧气所含的原子数为NA |
| B、1L0.5mol/L的HCl溶液中HCl分子数为0.5NA |
| C、常温常压下,32g氧气所含的氧原子数为2NA |
| D、18g NH4+所含的电子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、常温常压下,气体摩尔体积大于22.4L/mol;
B、盐酸溶液中无HCl分子;
C、根据氧气是由氧原子构成来计算;
D、1molNH4+含10mol电子.
B、盐酸溶液中无HCl分子;
C、根据氧气是由氧原子构成来计算;
D、1molNH4+含10mol电子.
解答:
解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氧气的物质的量小于0.5mol,故含有的原子数小于NA,故A错误;
B、HCl溶于水后完全电离,即盐酸溶液中无HCl分子,故B错误;
C、氧气是由氧原子构成的,故32g氧气中含氧原子的物质的量n=
=
=2mol,个数为2NA,故C正确;
D、18gNH4+的物质的量n=
=
=1mol,而1molNH4+含10mol电子,故D错误.
故选C.
B、HCl溶于水后完全电离,即盐酸溶液中无HCl分子,故B错误;
C、氧气是由氧原子构成的,故32g氧气中含氧原子的物质的量n=
| m |
| M |
| 32g |
| 16g/mol |
D、18gNH4+的物质的量n=
| m |
| M |
| 18g |
| 18g/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在固定容积的密闭容器中,可逆反应2X+Y(g)?Z(s)已达到平衡,此时升高温度则气体混合物的密度增大.下列叙述正确的是( )
| A、若X为非气态,则正反应为吸热反应 |
| B、正反应为放热反应,X一定为气态 |
| C、正反应为放热反应,X可能是气态、液态或固态 |
| D、若加入少量的Z,该平衡向左移动 |
下列说法错误的是( )
| A、钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 |
| B、某主族元素X的气态基态原子的逐级电离能分别是578、1817、2745、11575、14830、18376(kJ?mol-1)…,它与氯气反应所生成的物质的化学式为XCl2 |
| C、元素周期表中,处于非金属三角区边界的锗的电负性为1.8,则可以推测电负性为4.0的元素为非金属元素 |
| D、因为Be和Al的电负性都是1.5,所以处于周期表对角线位置的Be和Al的某些性质相似 |
下列盐中,既不是碱式盐,也不是酸式盐的是( )
| A、NaHSO4 |
| B、Cu2(OH)2CO3 |
| C、NH4NO3 |
| D、Ca(H2PO4)2 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA |
| B、0.1 mol?L-1的Na2CO3溶液中Na+数为0.1NA |
| C、若一筒120g的墨粉能打a个字,则平均每个字约含有10NA个碳原子 |
| D、0.5mol的甲基(-CH3)与氢氧根(OH-)所含电子数都为5NA |
A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是:( )
| 物质 编号 | 物质转化关系 | A | D | E |
| ① | 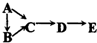 | Si | SiO2 | H2SiO3 |
| ② | N | NO2 | HNO3 | |
| ③ | S | SO2 | H2SO4 | |
| ④ | Na | Na2O2 | NaOH |
| A、①②③④ | B、②③ |
| C、①③④ | D、②④ |
下列离子方程式正确的是( )
| A、铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、铜跟稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| C、硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| D、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O |
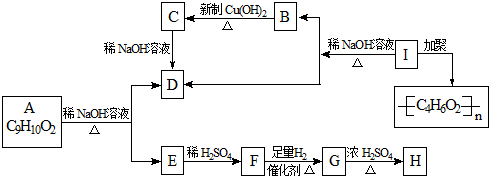
 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系