题目内容
11.用CCl4萃取碘的饱和水溶液中的碘,下列说法不正确的是( )| A. | 碘的CCl4溶液呈紫红色 | |
| B. | 碘在CCl4中的溶解度比在水中的溶解度大 | |
| C. | 萃取时,要充分振荡混合液体并适当旋转活塞排气减压 | |
| D. | 分液时,水从分液漏斗下口流出,碘的CCl4溶液从漏斗上口倒出 |
分析 碘在CCl4中的溶解度比在水中的溶解度大,可用四氯化碳萃取,萃取时,要检查分液漏斗是否漏液,充分振荡混合液体并适当旋转活塞排气减压,分液时,水从分液漏斗上口流出,碘的CCl4溶液从漏斗下口流出,以此解答该题.
解答 解:A.碘易溶于四氯化碳,CCl4溶液呈紫红色,故A错误;
B.碘在CCl4中的溶解度比在水中的溶解度大,可用四氯化碳萃取,故B正确;
C.振荡混合液体易使分液漏斗内压强过大,应适当旋转活塞排气减压,故C正确;
D.分液时,水从分液漏斗上口流出,碘的CCl4溶液从漏斗下口流出,易避免重新混合而污染,故D错误.
故选D.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意基础知识的巩固,注意相关化学实验的基本操作方法.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
15.下利金属既能与盐酸反应又能与NaOH溶液反应的是( )
| A. | Na | B. | Al | C. | Cu | D. | Fe |
2.在“粗盐提纯”的实验中,下列做法正确的是( )
| A. | 把浑浊的液体倒入蒸发皿内加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 加入试剂的顺序为Na2CO3、BaCl2、NaOH、HCl | |
| D. | 用过滤法除去粗盐中的泥沙 |
6.下列说法不正确的是( )
| A. | 燃烧热是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| B. | 工业上用点燃H2、Cl2混合气体的方法生产盐酸 | |
| C. | 金属钠着火时可用干燥的沙土来灭火 | |
| D. | 驰名世界的中国瓷器是硅酸盐材料 |
16.在101kPa和298K时,有关反应的热化学方程式有:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | O2前面的$\frac{1}{2}$表示参加反应的O2的分子数目 | |
| C. | 燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则 H2的燃烧热为285.8 kJ•mol-1 | |
| D. | 1 mol H2和$\frac{1}{2}$ mol O2所具有的总能量大于1mol H2O(g)所具有的总能量 |
3.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
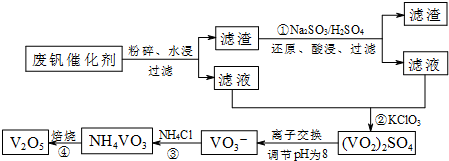
部分含钒物质在水中的溶解性如下:
(1)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据如图判断最佳控制氯化铵系数和温度为4和80℃.

(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:□VO2++□H2C2O4+□2H+=□VO2++□CO2↑+□H2O
(4)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++V2++2H+ $?_{充电}^{放电}$VO2++H2O+V3+,电池放电时正极的电极反应式为VO2++2H++e-═VO2++H2O.

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据如图判断最佳控制氯化铵系数和温度为4和80℃.

(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:□VO2++□H2C2O4+□2H+=□VO2++□CO2↑+□H2O
(4)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2++V2++2H+ $?_{充电}^{放电}$VO2++H2O+V3+,电池放电时正极的电极反应式为VO2++2H++e-═VO2++H2O.
1.下列物质中既含离子键又含共价键( )
| A. | MgCl2 | B. | NaOH | C. | CaO | D. | SO2 |
 .
.