题目内容
19.Mg3N2是一种在工业上应用非常广泛的离子化合物,室温下为黄绿色固体,遇水发生水解反应,需密封保存.某化学兴趣小组利用如图装置制取N2,并用N2制备Mg3N2.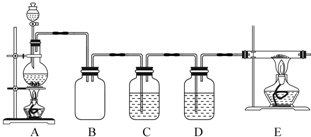
(1)已知饱和NH4Cl溶液与NaNO2晶体混合加热可制备氮气,写出该反应的化学方程式:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O.
(2)装置B的作用是防止发生倒吸,装置D中所装的试剂名称是浓硫酸,实验开始时,需要排除装置内的氧气,为了达到此目的,在装置C中盛放了酸性FeCl2溶液,该装置中发生反应的离子方程式为4Fe2++O2+4H+4Fe3+2H2O.
(3)实验结束后,取装置E的硬质玻璃管中的少量固体于试管中,加少量蒸馏水,把润湿的红色石蕊试纸放在管口,实验现象为试纸变蓝,发生反应的化学方程式为Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓.
(4)你认为产物中是否含有未反应的镁,请设计实验证明:取少量产物于试管中,加适量蒸馏水,振荡,静置,弃去上层清液,加入稀盐酸,若有气泡产生,则证明产物中含有未反应的镁;若没有气泡产生,则证明产物中没有未反应的镁.
(5)写出E装置中反应的化学方程式:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2,Mg3N2的电子式为
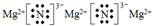 .
.
分析 A装置制备氮气,B为安全瓶,防止C中的溶液倒吸进入A中,C中放氯化亚铁是为了检验装置中的空气是否除尽,D中浓硫酸干燥氮气,E装置中氮气与Mg反应生成氮化镁,加热条件下装置中氧气与Mg反应生成MgO,应先用氮气排尽装置内空气后再制备氮化镁,
(1)饱和氯化铵溶液与亚硝酸钠晶体混合加热制备氮气,根据氮元素化合价的升降守恒书写方程式;
(2)B为安全瓶,可防止倒吸,产生的氮气需干燥才能通入玻璃管中反应,D为干燥氮气的装置,C为了检验装置中的空气是否除尽;
(3)氮化镁和水反应生成氢氧化镁和氨气;
(4)先加入水除去氮化镁,再加入盐酸,如生成气体,可说明含有镁;
(5)E装置为氮气与镁高温加热发生反应生成氮化镁的装置,氮化镁为离子化合物.
解答 解:A装置制备氮气,B为安全瓶,防止C中的溶液倒吸进入A中,C中放氯化亚铁是为了检验装置中的空气是否除尽,D中浓硫酸干燥氮气,E装置中氮气与Mg反应生成氮化镁,加热条件下装置中氧气与Mg反应生成MgO,应先用氮气排尽装置内空气后再制备氮化镁,
(1 )饱和氯化铵溶液与亚硝酸钠晶体混合加热制备氮气,根据氮元素化合价的升降守恒,反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,
故答案为:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O;
(2)B为安全瓶,可防止倒吸,产生的氮气需干燥才能通入玻璃管中反应,D为干燥氮气的装置,选用浓硫酸作干燥剂;C中放氯化亚铁是为了检验装置中的空气是否除尽,若有氧气,二价铁会被氧化为三价铁,反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:防止发生倒吸;浓硫酸;4Fe2++O2+4H +4Fe3+2H2O;
(3)氮化镁和水反应生成氢氧化镁和氨气,反应的方程式为Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓,把润湿的红色石蕊试纸放在管口,可观察到试纸变蓝,
故答案为:试纸变蓝;Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓;
(4)固体于试管中,加少量蒸馏水,以除去Mg3N2;弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是验证产物中是否含有未反应的镁,若有应该产生气泡,
故答案为:取少量产物于试管中,加适量蒸馏水,振荡,静置,弃去上层清液,加入稀盐酸,若有气泡产生,则 证明产物中含有未反应的镁;若没有气泡产生,则证明产物中没有未反应的镁;
(5)E装置为氮气与镁高温加热发生反应生成氮化镁的装置,反应的方程式为3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2,氮化镁的电子式为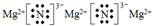 ,
,
故答案为:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2;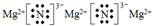 .
.
点评 本题考查物质制备实验,为高考常见题型,注意把握对制备原理与各装置的理解,注意制备中避免水解及杂质生成,题目综合考查学生对知识的迁移运用、分析能力、实验能力等,掌握元素化合 物性质与实验制备原则.

| A. | 17gOH-中含有的电子数为10NA | |
| B. | 标准状况下,lmol CCl4的体积约为22.4L | |
| C. | 1mol/LNa2CO3溶液中含有的Na+离子数为2NA | |
| D. | 常温常压下,1NA个CO2分子占有的体积为22.4L |
| A. | 2△H和2K | B. | -2△H和K2 | C. | 2△H和-2K | D. | -2△H和K-2 |
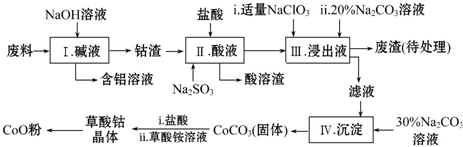
已知:部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
(1)步骤Ⅰ中得到含铝溶液的溶质是NaAlO2.
(2)写出步骤Ⅱ中Co2O3与Na2SO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,则该有毒气体是Cl2,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,洗涤的方法是在漏斗中加水没过沉淀,让水自行留下,重复2~3次.
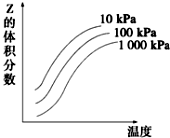 图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )
图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | 增大压强平衡向正反应方向移动 | D. | 上述反应的逆反应的△H<0 |
| A. | 碘的CCl4溶液呈紫红色 | |
| B. | 碘在CCl4中的溶解度比在水中的溶解度大 | |
| C. | 萃取时,要充分振荡混合液体并适当旋转活塞排气减压 | |
| D. | 分液时,水从分液漏斗下口流出,碘的CCl4溶液从漏斗上口倒出 |
| A. | 苯和液溴在FeBr3催化作用下生成溴苯 | |
| B. | 丙烯和氯气在一定条件下反应生成ClCH2CH=CH2的反应 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯与HCl气体反应生成一氯乙烷 |
| A. | 原子总数 | B. | 摩尔质量 | C. | 分子总数 | D. | 质量 |