题目内容
9.下列反应的离子方程式书写正确的是( )| A. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氢氧化铁与稀盐酸反应:OH-+H+═H2O | |
| C. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.氢氧化铁为难溶物,离子方程式中不能拆开;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:A.氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+,故A错误;
B.氢氧化铁与稀盐酸反应生成氯化铁和水,正确的离子方程式为:Fe(OH)3+3H+═3H2O+Fe3+,故B错误;
C.钠与水的反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.金属铝与NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
19.能说明某温度下,反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在密闭容器中,已达到平衡状态的是( )
| A. | NH3、NO消耗的速率相等 | |
| B. | 容器内NH3、O2、NO、H2O四种气体共存 | |
| C. | NO、H2O的生成速率相等 | |
| D. | 单位时间内NH3、O2消耗的物质的量相等 |
17.下列物质不能使湿润的淀粉碘化钾试纸变蓝的是( )
| A. | 液氯 | B. | NO2 | C. | 碘水 | D. | 盐酸 |
4.下列除杂方法正确的是(括号内为杂质)( )
| A. | SO2(HCl)通过饱和Na2SO3溶液 | |
| B. | Na2CO3溶液(NaHCO3)滴加足量BaCl2溶液 | |
| C. | H2(H2S)通过CuSO4溶液 | |
| D. | Na2SO4溶液(Na2SO3)滴加足量HCl溶液 |
14.下列物质能在空气中稳定存在的是( )
| A. | 氢氧化亚铁悬浊液 | B. | 氧化钠 | ||
| C. | 二氧化硅 | D. | 氯水 |
5.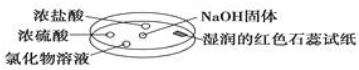 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与挥发出来的HCl气体反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
| A. | A | B. | B | C. | C | D. | D |
2. 673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )
673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )
 673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )
673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )| A. | c点的正反应速率与逆反应速率相等 | |
| B. | d点和e点的n(Z)不相等 | |
| C. | d点的反应速大于e点的反应速率 | |
| D. | 其他条件不变.将容器容积缩小到一半.反应至t1时刻.c(Y)比图中的d点大. |
3.设NA为阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 0.1molNaCl固体中含0.1NA个阳离子 | |
| B. | 22.4LCO2含有的原子数是3NA | |
| C. | 常温常压下,NA个H2质量为2g | |
| D. | 1molMg与足量O2反应,失去的电子数是2NA |