题目内容
 在20.0mL 0.10mol?L-1的盐酸溶液中滴加0.10mol?L-1 NaOH溶液,并以酚酞为指示剂.
在20.0mL 0.10mol?L-1的盐酸溶液中滴加0.10mol?L-1 NaOH溶液,并以酚酞为指示剂.(1)填写下表中的空格(结果保留一位小数).
| ①V(NaOH)(mL) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 |
| ②溶液的pH | 1.0 | 2.3 | 3.3 | 4.3 | 7 | 9.7 | 10.7 |
(3)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、氧化还原滴定等.某学生测定食用精制盐中的碘含量(食盐中加入一定量的KIO3).
已知:I2+2S2O32-═2I-+S4O62-,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3mol/L的Na2S2O3溶液15.00mL,恰好反应完全.
①配平化学方程式
②判断c中反应恰好完全依据的现象是
③根据以上实验,所测精制食盐中的碘含量是
考点:酸碱混合时的定性判断及有关ph的计算,化学方程式的有关计算,氧化还原反应方程式的配平
专题:氧化还原反应专题,电离平衡与溶液的pH专题
分析:(1)根据酸碱混合后溶液中剩余的氢离子或者氢氧根离子的物质的量计算出浓度,再计算出溶液的pH;
(2)根据表中滴定数据画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图;
(3)①根据氧化还原反应中化合价升高和降低相等配平反应的方程式;
②反应结束前溶液为蓝色,滴定结束时溶液蓝色褪去,据此判断滴定终点现象;
③根据反应I2+2S2O32-═2I-+S4O62-、KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O找出反应关系式:3I2~6S2O32-~KIO3,根据滴定消耗Na2S2O3的物质的量计算出碘酸钾的物质的量,再计算出w g食盐中碘含量.
(2)根据表中滴定数据画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图;
(3)①根据氧化还原反应中化合价升高和降低相等配平反应的方程式;
②反应结束前溶液为蓝色,滴定结束时溶液蓝色褪去,据此判断滴定终点现象;
③根据反应I2+2S2O32-═2I-+S4O62-、KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O找出反应关系式:3I2~6S2O32-~KIO3,根据滴定消耗Na2S2O3的物质的量计算出碘酸钾的物质的量,再计算出w g食盐中碘含量.
解答:
解:(1)滴入19.96mL氢氧化钠溶液后,溶液中盐酸过量,剩余的氢离子的物质的量浓度为:c(H+)=
≈1×
10-4mol/L,溶液pH=4.0;加入20.04mL氢氧化钠溶液后,氢氧化钠过量,溶液显示碱性,溶液中氢氧根离子浓度浓度为:c(OH-)=
≈1×10-4mol/L,溶液的pH=10,
故答案为:4.0;10.0;
(2)根据表中数据,可以画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图为: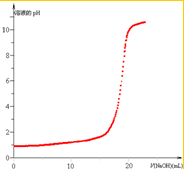 ,
,
故答案为: ;
;
(3)①碘酸钾溶液中碘离子化合价为+5价,反应后生成中碘单质的化合价为0价,化合价降低了5价;碘离子化合价由-1价变成了0价,化合价升高了5价,化合价变化的最小公倍数为5,所以碘酸钾的计量数为1,碘化钾的计量数为5,观察法配平气体物质,则配平后的化学方程式为:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3;
②原溶液中生成了碘单质,加入淀粉后溶液变成蓝色,当反应结束时碘单质消失,溶液变成无色,所以滴定终点的现象为:溶液的蓝色恰好褪去,且半分钟内不恢复,
故答案为:溶液的蓝色恰好褪去,且半分钟内不恢复;
③wg食盐消耗的Na2S2O3的物质的量为:2.000×10-3mol/L×0.015L=3.0×10-5mol;
根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-═2I-+S4O62-可得反应关系式:KIO3~3I2~6S2O32-,n(KIO3)=
n(S2O32-)=5.0×10-6mol,wg食盐中碘元素的含量为:
=
mg/kg,
故答案为:
.
| 0.1mol/L×0.020L-0.10mol/L×0.01996L |
| 0.02L+0.01996L |
10-4mol/L,溶液pH=4.0;加入20.04mL氢氧化钠溶液后,氢氧化钠过量,溶液显示碱性,溶液中氢氧根离子浓度浓度为:c(OH-)=
| 0.1mol/L×0.0204L-0.10mol/L×0.020L |
| 0.0204L+0.020L |
故答案为:4.0;10.0;
(2)根据表中数据,可以画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图为:
 ,
,故答案为:
 ;
;(3)①碘酸钾溶液中碘离子化合价为+5价,反应后生成中碘单质的化合价为0价,化合价降低了5价;碘离子化合价由-1价变成了0价,化合价升高了5价,化合价变化的最小公倍数为5,所以碘酸钾的计量数为1,碘化钾的计量数为5,观察法配平气体物质,则配平后的化学方程式为:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3;
②原溶液中生成了碘单质,加入淀粉后溶液变成蓝色,当反应结束时碘单质消失,溶液变成无色,所以滴定终点的现象为:溶液的蓝色恰好褪去,且半分钟内不恢复,
故答案为:溶液的蓝色恰好褪去,且半分钟内不恢复;
③wg食盐消耗的Na2S2O3的物质的量为:2.000×10-3mol/L×0.015L=3.0×10-5mol;
根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-═2I-+S4O62-可得反应关系式:KIO3~3I2~6S2O32-,n(KIO3)=
| 1 |
| 6 |
| 5.0×10-6mol×127×103mg/mol |
| w×10-3kg |
| 635mg |
| w |
故答案为:
| 635 |
| w |
点评:本题考查了酸碱混合后溶液pH的计算、氧化还原反应方程式的配平等知识,题目难度较大,试题涉及的内容较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
相关题目
下列化学用语或模型正确的是( )
| A、CO2的结构式:O-C-0 |
B、氟化钠的电子式: |
C、CCl4分子的比例模型: |
D、金刚石的结构模型: |
某固体A在一定条件下加热分解,产物全是气体,A的分解反应为:2A
B↑+2C↑+2D↑,现测得分解产生的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
| ||
| A、2d | B、10d |
| C、5d | D、0.8d |
设阿伏加德罗常数为NA,下列叙述中正确的是( )
| A、常温常压下,32克氧气中原子个数为NA |
| B、标准状况下,1mol H2O的体积为22.4L |
| C、常温常压下,1mol H2的质量为2克 |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |
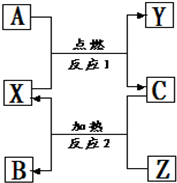 A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:
A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答: