题目内容
(1)按要求写出下列反应的离子方程式:
①少量二氧化碳通入澄清石灰水
②硫酸氢钠与过量氢氧化钡溶液混合
②熔融状态下NaHSO4电离方程式
(2)①用双线桥表示下列氧化还原反应电子转移:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
②配平下面方程式:
KMnO4+ H2O2+ H2SO4═ K2SO4+ MnSO4+ O2↑+ H2O.
①少量二氧化碳通入澄清石灰水
②硫酸氢钠与过量氢氧化钡溶液混合
②熔融状态下NaHSO4电离方程式
(2)①用双线桥表示下列氧化还原反应电子转移:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
②配平下面方程式:
考点:离子方程式的书写,氧化还原反应方程式的配平
专题:氧化还原反应专题,离子反应专题
分析:(1)①少量的二氧化碳生成碳酸钙,澄清石灰水用离子符号;
②少量的硫酸氢钠要符合组成之比;
③熔融状态下共价键不断裂;
(2)①用双线桥表示下列氧化还原反应电子转移,起止于同一变化的元素,线桥跨越反应物和生成物;
②参与氧化还原反应的各元素化合价全变化,从左边配,选配氧化剂和还原剂前面的系数,然后根据物料守恒配平.
②少量的硫酸氢钠要符合组成之比;
③熔融状态下共价键不断裂;
(2)①用双线桥表示下列氧化还原反应电子转移,起止于同一变化的元素,线桥跨越反应物和生成物;
②参与氧化还原反应的各元素化合价全变化,从左边配,选配氧化剂和还原剂前面的系数,然后根据物料守恒配平.
解答:
解:(1)①少量的二氧化碳生成碳酸钙,澄清石灰水用离子符号,离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O,故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
②少量的硫酸氢钠要符合组成之比,离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O,故答案为:H++SO42-+Ba2++OH-=BaSO4↓+H2O;
③熔融状态下共价键不断裂,电离方程式为NaHSO4=Na++HSO4-,故答案为:NaHSO4=Na++HSO4-;
(2)①起止于同一变化的元素,线桥跨越反应物和生成物, ,
,
故答案为: ;
;
②KMnO4中Mn+7→+2降低5 而 H2O2 中的O由-1→0升高1×2 升降守恒,两者的最小公倍数为10,所以高锰酸钾前面的系数为2,过氧化氢前面的系数为5,然后根据物料守恒得其它物质前面的系数,故答案为:2;5;3;1;2;5;8.
②少量的硫酸氢钠要符合组成之比,离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O,故答案为:H++SO42-+Ba2++OH-=BaSO4↓+H2O;
③熔融状态下共价键不断裂,电离方程式为NaHSO4=Na++HSO4-,故答案为:NaHSO4=Na++HSO4-;
(2)①起止于同一变化的元素,线桥跨越反应物和生成物,
 ,
,故答案为:
 ;
;②KMnO4中Mn+7→+2降低5 而 H2O2 中的O由-1→0升高1×2 升降守恒,两者的最小公倍数为10,所以高锰酸钾前面的系数为2,过氧化氢前面的系数为5,然后根据物料守恒得其它物质前面的系数,故答案为:2;5;3;1;2;5;8.
点评:本题考查离子方程式的书写和氧化还原反应中电子转移方向的表示方法,以及氧化还原反应的配平,难度中等.

练习册系列答案
相关题目
在稀盐酸中能大量共存的离子组是( )
| A、Ag+、Ba2+、C1一 |
| B、Na+、SO32一、S2一 |
| C、NH4+、Mg2+、SO42- |
| D、K+、Fe2+、OH- |
下列离子方程式不正确的是( )
| A、向碳酸氢钠溶液滴加NaOH溶液 HCO3-+OH-=CO32-+H2O |
| B、MgO溶于盐酸中:O2-+2H+=H2O |
| C、镁和稀硫酸反应 Mg+2H+=Mg2++H2↑ |
| D、氯气与水反应 Cl2+H2O?2H++Cl-+ClO- |
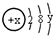 ,试回答:
,试回答: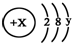 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题: