题目内容
反应SO2(g)+NO2(g)?SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和
NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下.
(1)此反应的平衡常数.
(2)相同温度下,若SO2(g)的初始浓度增大到3mol/L,NO2(g)的初始浓度仍为2mol/L,则SO2(g)、NO2(g)的转化率变为多少?
NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下.
(1)此反应的平衡常数.
(2)相同温度下,若SO2(g)的初始浓度增大到3mol/L,NO2(g)的初始浓度仍为2mol/L,则SO2(g)、NO2(g)的转化率变为多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 2 2 0 0
变化量(mol/L) 1 1 1 1
平衡量(mol/L) 1 1 1 1
(1)依据平衡常数概念列式计算得到;
(2)依据平衡三段式,结合平衡常数计算.
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 2 2 0 0
变化量(mol/L) 1 1 1 1
平衡量(mol/L) 1 1 1 1
(1)依据平衡常数概念列式计算得到;
(2)依据平衡三段式,结合平衡常数计算.
解答:
解:当达到平衡状态时,测得容器中SO2(g)的转化率为50%,
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 2 2 0 0
变化量(mol/L) 1 1 1 1
平衡量(mol/L) 1 1 1 1
(1)反应平衡常数K=1,答:反应的平衡常数为1;
(2)相同温度下,若SO2(g)的初始浓度增大到3mol/L,NO2(g)的初始浓度仍为2mol/L,设消耗二氧化硫浓度为x;
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 3 2 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 3-x 2-x x x
平衡常数K=
=1
x=1.2mol/L
则SO2(g)转化率=
×100%=40%,
NO2(g)的转化率=
×100%=60%,
答:SO2(g)转化率从50%变化为40%,NO2(g)的转化率50%变为60%.
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 2 2 0 0
变化量(mol/L) 1 1 1 1
平衡量(mol/L) 1 1 1 1
(1)反应平衡常数K=1,答:反应的平衡常数为1;
(2)相同温度下,若SO2(g)的初始浓度增大到3mol/L,NO2(g)的初始浓度仍为2mol/L,设消耗二氧化硫浓度为x;
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 3 2 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 3-x 2-x x x
平衡常数K=
| x2 |
| (3-x)(2-x) |
x=1.2mol/L
则SO2(g)转化率=
| 1.2mol/L |
| 3mol/L |
NO2(g)的转化率=
| 1.2mol |
| 2mol |
答:SO2(g)转化率从50%变化为40%,NO2(g)的转化率50%变为60%.
点评:本题考查了化学平衡计算的分析应用,主要是平衡常数、转化率概念的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
检验久置苛性钠溶液中含有少量纯碱的方法是( )
| A、滴加少量盐酸有气泡冒出 |
| B、通入少量CO2气体有浑浊现象 |
| C、加热产生气泡 |
| D、加入BaCl2溶液有白色沉淀生成 |
 如图所示,下列叙述正确的是( )
如图所示,下列叙述正确的是( )| A、过程中溶液的PH会减小 |
| B、锌为正极,发生氧化反应 |
| C、铜棒上反应为2H++2e=H2↑ |
| D、电流方向从Zn经导线到Cu |
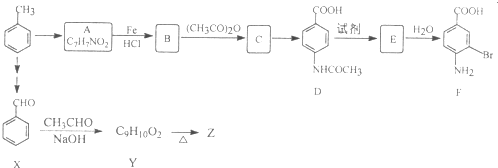
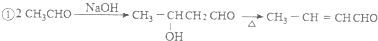
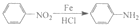 苯胺中氨基易被氧化.
苯胺中氨基易被氧化.