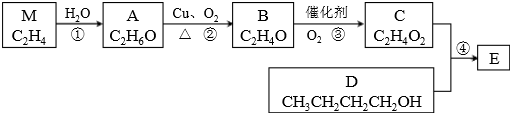
题目内容
6.居室内空气污染物的主要来源是人们使用的装饰材料、胶黏剂、内墙涂料等释放出来的一种有刺激性气味的气体.据此判断,下列说法不正确的是( )| A. | 这种气体是甲醛 | |
| B. | 这种气体是苯 | |
| C. | 该气体可用新制氢氧化铜悬浊液进行检验 | |
| D. | 这种气体可使酸性高锰酸钾溶液褪色 |
分析 居室由于装饰材料释放出来的有机污染物为苯、甲醛,为常见的有机溶剂,易挥发且有毒,苯、甲醛能使蛋白质失去原有的生理活性而变性,一些装饰材料、胶合板、涂料等会不同程度地释放出苯、甲醛气体,而使室内空气中苯、甲醛含量超标,成为室内空气污染的主要原因之一.
解答 解:A.有些装饰材料、胶合板、涂料等中添加的甲醛的不同程度地挥发,而使室内空气中甲醛含量超标,导致室内空气污染;故A正确;
B.苯是特殊香味的气体,故B错误;
C.甲醛具有醛的性质,结构简式可以表示为:HCHO,与新制氢氧化铜悬浊液受热,甲醛中的醛基被氧化,生成二氧化碳,自身被还原成氧化亚铜,可用新制氢氧化铜悬浊液进行检验,苯与新制氢氧化铜悬浊液不反应,所以该气体可用新制氢氧化铜悬浊液进行检验,故C正确;
D.甲醛具有还原性,能被酸性高锰酸钾溶液氧化,酸性高锰酸钾溶液褪色,但苯不能,故D错误;
故选BD.
点评 本题考查常见的环境污染物,注意把握信息中“由于装饰材料释放出来的污染物有刺激性气味”即可解答,把握有机物的性质是解答的关键,题目难度不大.

练习册系列答案
相关题目
9.某溶液中可能含有物质的量浓度相等的下列离子中的几种:Fe3+、Cu2+、Na+、H+、Cl-、SO42-、CO32-、I-,取少量上述溶液分别进行如下实验:①一份中加人少量锌粉后,固体溶解完但无其他变化;②一份加入BaCl2溶液后得到白色沉淀,下列有关判断正确的是( )
| A. | 溶液中只含Fe3+、SO42-、Cl- | |
| B. | 溶液中只含Cu2+、SO42- | |
| C. | 需要利用焰色反应才能确定有无Na+ | |
| D. | 溶液中肯定没有I-但无法确定有无Cl- |
1. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,正反应速率等于逆反应速率 | |
| D. | t3后,若升高温度则反应速率不一定增大 |
11.下列反应属于吸热反应的是( )
| A. | C6H12O6(葡萄糖)+6O2═6CO2+6H2O | B. | CH3COOH+KOH═CH3COOK+H2O | ||
| C. | 所有高温条件下发生的反应 | D. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO |
18.用如所示装置除去含CN-,Cl- 废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无毒的气体,下列说法正确的是( )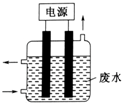

| A. | 该电解装置电极材料均为铁 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 该装置排放出的气体主要为N2和CO2 |
15.25℃时,由水电离出c(OH-)=1×10-11mol/L 的溶液中,可能能大量共存的离子组是( )
| A. | Al3+、NH4+、Cl-、CO32- | B. | Na+、CH3COO-、K+、HCO3- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、I-、CO3-、Na+ |
16.中国和瑞典的科学家共同发现了治疗非典的新方法:吸入一氧化氮可快速改善重症非典患者的缺氧状况,缓解病情.病毒学研究同时证实,一氧化氮对非典病毒有直接抑制作用.下列有关NO的说法不正确的是( )
| A. | NO任意排放会造成大气污染 | |
| B. | 汽车尾气、制硝酸工厂的废气均含NO | |
| C. | NO是造成光化学烟雾的唯一直接原因 | |
| D. | NO分子所含电子总数为奇数 |