题目内容
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O
设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol?L-1,盐桥中装有饱和K2SO4溶液.回答下列问题:
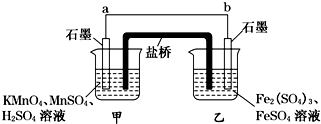
(1)发生氧化反应的烧杯是 (填“甲”或“乙”).
(2)外电路的电流方向为:从 到 (填“a”或“b”).
(3)电池工作时,盐桥中的SO42-移向 (填“甲”或“乙”)烧杯.
(4)甲烧杯中发生的电极反应为 .
(5)已知燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-═CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为: .随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol?L-1,盐桥中装有饱和K2SO4溶液.回答下列问题:

(1)发生氧化反应的烧杯是
(2)外电路的电流方向为:从
(3)电池工作时,盐桥中的SO42-移向
(4)甲烧杯中发生的电极反应为
(5)已知燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-═CO32-+7H2O,这个电极是燃料电池的
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)-(4)由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答;
(5)燃料电池中,负极上失电子发生氧化反应,正极上氧化剂得电子发生还原反应;根据电池反应式中氢氧根离子浓度是否变化分析解答.
(5)燃料电池中,负极上失电子发生氧化反应,正极上氧化剂得电子发生还原反应;根据电池反应式中氢氧根离子浓度是否变化分析解答.
解答:
解:由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,
(1)b为负极,则乙烧杯中发生氧化反应,故答案为:乙;
(2)由上述分析可知,a为正极,电流由正极流向负极,即从a流向b,故答案为:a;b;
(3)阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故答案为:乙;
(4)甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,故答案为:MnO4-+8H++5e-═Mn2++4H2O;
(5)CH4+10OH--8e-═CO32-+7H2O中C元素化合价由-4价变为+4价,所以甲烷失电子发生氧化反应,其所在电极为负极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为2O2+4H2O+8e-═8OH-,该燃料电池电池反应式为CH4+10OH--8e-═CO32-+7H2O,氢氧根离子参加反应,所以反应过程中氢氧根离子浓度减小,溶液的pH减小,故答案为:负极;O2+2H2O+4e-═4OH-;减小.
(1)b为负极,则乙烧杯中发生氧化反应,故答案为:乙;
(2)由上述分析可知,a为正极,电流由正极流向负极,即从a流向b,故答案为:a;b;
(3)阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故答案为:乙;
(4)甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,故答案为:MnO4-+8H++5e-═Mn2++4H2O;
(5)CH4+10OH--8e-═CO32-+7H2O中C元素化合价由-4价变为+4价,所以甲烷失电子发生氧化反应,其所在电极为负极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为2O2+4H2O+8e-═8OH-,该燃料电池电池反应式为CH4+10OH--8e-═CO32-+7H2O,氢氧根离子参加反应,所以反应过程中氢氧根离子浓度减小,溶液的pH减小,故答案为:负极;O2+2H2O+4e-═4OH-;减小.
点评:本题考查原电池的工作原理及常见的化学电源,明确氧化还原反应中元素的化合价变化及原电池工作原理是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组反应,实质都是取代反应的是( )
| A、苯硝化,苯酚和溴水反应,皂化反应,乙烯与溴水反应 |
| B、酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应 |
| C、淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 |
| D、纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
在一支25ml的碱式滴定管中,盛装溶液时液面恰好在10.00ml处.若将管内液体全部放出,所得溶液的体积为( )
| A、10.00ml |
| B、15.00ml |
| C、大于15.00ml |
| D、小于15.00ml |
25℃时,水中存在电离平衡:H2O?H++OH-△H>0.下列叙述正确的是( )
| A、升高温度,Kw增加,pH增大 |
| B、向水中加入少量NaOH固体,平衡向逆方向移动,c(OH-)增大 |
| C、向水中加入少量CH3COONa固体,平衡向正方向移动,c(H+)增大 |
| D、25℃时,纯水中c(H+)>10-7mol/L |
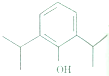 2009年8月25日洛杉矶首席验尸官在休斯顿法庭上公布流行音乐天王杰克逊被注射异丙酚,“天王星”就此陨落.异丙酚是一种强力的镇静剂,常被麻痹医生称为“牛奶”.其结构如图所示,下列有关异丙酚的说法不正确的是( )
2009年8月25日洛杉矶首席验尸官在休斯顿法庭上公布流行音乐天王杰克逊被注射异丙酚,“天王星”就此陨落.异丙酚是一种强力的镇静剂,常被麻痹医生称为“牛奶”.其结构如图所示,下列有关异丙酚的说法不正确的是( )| A、能发生加成反应 |
| B、能和FeCl3溶液发生显色反应 |
| C、能与Na2CO3溶液发生反应 |
| D、分子中所有碳原子都在同一平面上 |
NA表示阿伏加德罗常数,以下各物质所含分子数最少的是( )
| A、含2NA个氢分子的氢气 |
| B、17g氨气(NH3的摩尔质量为17g?mol-l) |
| C、0.8mol氧气 |
| D、标准状况下11.2 L氯气 |