题目内容
18. 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
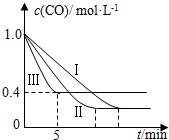
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、0.1mol CO2(g)、0.1mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
分析 (1)根据盖斯定律来计算反应的焓变,可写出热化学方程式;
(2)①由图表可知,曲线II和曲线I相比,平衡不移动,只是缩短了反应达平衡的时间,据此分析反应II的条件;
②由图象可知,CO的平衡浓度为0.4mol/L,即可知△c(CO)=0.6mol/L,根据反应速率的公式求算;
③CO的平衡浓度越大,则其平衡转化率越低;
④求出反应的浓度商Qc,与K做比较即可.
解答 解:(1)根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol,
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol;
(2)①由图表可知,曲线II和曲线I相比,平衡不移动,只是缩短了反应达平衡的时间,故II和I不同的条件为压强,且为增大压强,故Y为5MPa,两者的温度应相同,故X为530℃,故答案为:530;5;
②由图象可知,CO的平衡浓度为0.4mol/L,即可知△c(CO)=0.6mol/L,根据反应速率的公式V(CO)=$\frac{0.6mol/L}{5min}$=0.12mol•L-1•min-1.
故答案为:0.12;
③CO的平衡浓度越大,则其平衡转化率越低,故实验Ⅱ达平衡时CO的转化率大于实验Ⅲ达平衡时CO的转化率,故答案为:大于;
④若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),则此时反应的浓度商Qc=$\frac{0.1mol/L×0.1mol/L}{0.2mol/L×0.2mol/L}$=0.25<K,则此时反应应向正反应方向移动,故答案为:正向.
点评 本题考查较为综合,涉及盖斯定律的应用、影响化学反应速率和化学平衡的因素以及化学平衡常数的计算,为高频考点和常见题型,题目综合性较强,难度适中.

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案| A. | C(Na+)=2C(S2-)+2C(HS-)+2C(H2S) | B. | C(Na+)+C(H+)=C(OH-)+C(HS-)+C(S2-) | ||
| C. | C(OH-)=C(H+)+C(HS-)+2(H2S) | D. | C(Na+)>C(S2-)>C(OH-)>C(HS-) |
| A. | 粘胶纤维 | B. | 涤纶 | C. | 丙纶 | D. | 木材 |
| A. | Ksp(AB2)小于Ksp(CD),则化合物AB2的溶解度一定小于化合物CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的溶解度增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
| A. | Ksp只与难溶电解质的性质和温度有关 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| C. | 难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,则AgCl饱和水溶液体系中c(Ag+)为$\sqrt{1.8}$×10-5mol/L |
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、c (Fe2+)都减小 | |
| D. | 该反应平衡常数 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
| A. | 两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | 两途径最终达到平衡时,体系内混合气体的百分组成不同 | |
| C. | 途径Ⅰ到达平衡所用时间一定等于途径Ⅱ到达平衡所用时间 | |
| D. | 达平衡时,途径Ⅰ所得混合气体的密度等于途径Ⅱ所得混合气密度的一半 |
 SO2和NOx都是大气污染物.
SO2和NOx都是大气污染物.