题目内容
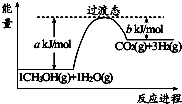
3.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是反应①:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-283kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H3=-242kJ•mol-1
则反应①的△H=△H1-△H2-3×△H3(用△H1、△H2和△H3表示).
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图1所示.
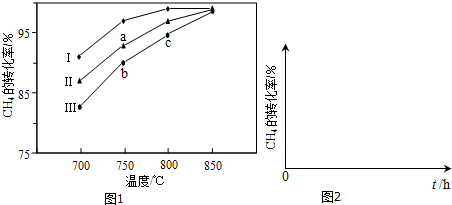
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
②a点所代表的状态不是(填“是”或“不是”)平衡状态.
③c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
(3)反应①在恒容密闭反应器中进行,CH4和H2O的起始物质的量之比为1:2,10h后CH4的转化率为80%,并测得c(H2O)=0.132mol•L-1,计算0~10h内消耗CH4的平均反应速率(写出计算过程,结果保留2位有效数字).
(4)在如图2的坐标图中,画出反应①分别在700℃和850℃下进行时,CH4的转化率随时间t变化的示意图(进行必要标注).
分析 (1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-283kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H3=-242kJ•mol-1
利用盖斯定律将①-②-3×③可得:CH4(g)+H2O(g)=CO(g)+3H2(g)的反应热;
(2)根据图象,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率为Ⅰ>Ⅱ>Ⅲ,结合催化剂只改变反应速率不改变平衡移动,所以最终不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同;
(3)依据化学平衡的三段式结合平均反应速率V=$\frac{△c}{△t}$列式计算;
(4)CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,根据温度减小反应速率减小及达到平衡时CH4的转化率减小,据此画出在700℃和850℃下进行时,CH4的转化率随时间t变化的示意图.
解答 解:(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-283kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H3=-242kJ•mol-1
利用盖斯定律将①-②-3×③可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=△H1-△H2-3×△H3,
故答案为:△H1-△H2-3×△H3;
(2)①根据图象,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率为Ⅰ>Ⅱ>Ⅲ,所以三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ,故答案为:Ⅰ>Ⅱ>Ⅲ;
②因为催化剂只改变反应速率不改变平衡移动,所以最终不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同,故a点所代表的状态不是平衡状态,
故答案为:不是;
③此时反应一直向正反应方向移动,b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高,所以c点CH4的转化率高于b点,
故答案为:b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高;
(3)依据化学平衡的三段式列式计算,设CH4与H2O(g)物质的量为a,2a;
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol•L-1) a 2a 0 0
变化量(mol•L-1) 2a-0.132 2a-0.132 2a-0.132 6a-0.396
平衡量(mol•L-1) 0.132-a 0.132 2a-0.132 6a-0.396
10h后CH4的转化率为80%,则$\frac{2a-0.132}{a}$=80%,解得a=0.11,所以0~10h内消耗CH4的平均反应速率V=$\frac{△c}{△t}$=$\frac{(2×0.11-0.132)mol/L}{10h}$=8.8×10-3mol/(L•h),
答:0~10h内消耗CH4的平均反应速率为8.8×10-3mol/(L•h);
(4)700℃时化学反应速率比850℃的小,曲线斜率则700℃小,达到平衡需要的时间长,由于该反应为吸热反应,温度降低,CH4的转化率也减小,所以达到平衡时700℃时CH4的转化率比850℃的小,据此画出700℃时CO2的转化率随时间变化的示意图为 ,
,
故答案为: .
.
点评 本题考查较为综合,涉及盖斯定律的应用及其化学平衡的影响因素、化学平衡的计算,为高考常见题型,题目难度中等,注意明确化学平衡的影响因素,掌握利用三段式进行化学平衡的计算方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| B. | PM2.5是指大气中直径接近于2.5μm(1m=106μm=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| C. | 为提高农作物产量大量使用农药和化肥 | |
| D. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 甲烷的结构式:CH4 | D. | 甲苯的键线式: |
 恒温下,向一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
恒温下,向一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
A.N2、H2和NH3的浓度不再变化
B.单位时间内消耗n mol N2同时消耗3nmol H2
C.1mol氮氮三键断裂同时6molN-H键断裂
D.容器内总压强不随时间而变化
E.混合气体的密度保持不变
F.混合气体的平均相对分子质量不再改变
②此条件下该反应的化学平衡常数K=0.1,若温度不变,只将容器体积由4L变为2L,达到新平衡时N2的平衡浓度>0.4mol•L-1(填“>”、“=”或“<”).
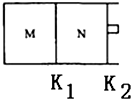
③如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列有关说法中不正确的是A.
A.反应达到平衡时N2的转化率:M>N
B.H2的体积分数:M>N
C.容器N中达到平衡,测得容器中含有1.2mol NH3,此时N的容积为VL,则该反应在此条件下的平衡常数K=
$\frac{24{V}^{2}}{12}$
D.该反应在T℃时的平衡常数K:M=N.
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
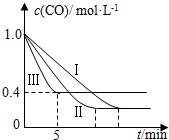
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、0.1mol CO2(g)、0.1mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
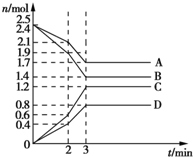 在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )
在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )| A. | 前2min内,v(A)=0.2 mol/(L•min) | |
| B. | 在2min时,图象发生改变的原因只可能是增大压强 | |
| C. | 其他条件不变,3min时体系的压强不再发生变化 | |
| D. | 增加气体D的浓度,A的反应速率随之减小 |
| A. | Na2CO3 | B. | NaOH | C. | Mg(OH)2 | D. | NH3•H2O |