题目内容
4. 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)称取粗盐$→_{①}^{操作A}$$→_{②}^{BaCl_{2}}$$→_{③}^{NaOH}$$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{操作B}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
(1)判断BaCl2已过量的方法是取第②步后的上层清液1~2滴于滴定板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
(2)第①步中,操作A是溶解,第⑤步中,操作B过滤.
(3)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl
(4)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
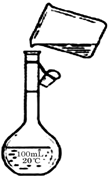
(5)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流,未采用250mL容量瓶.
分析 除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,操作①为溶解后,②中加氯化钡除去SO42-,③中加NaOH除去Mg2+,④中加碳酸钠除去Ca2+及过量的氯化钡,⑤中操作B为过滤,过滤后,⑥中加盐酸,⑦为蒸发、结晶、烘干,得到精盐,以此来解答.
解答 解:(1)判断BaCl2已过量的方法是取第②步后的上层清液1~2滴于滴定板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,故答案为:取第②步后的上层清液1~2滴于滴定板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)第①步中,操作A是溶解,第⑤步中,操作B为过滤,
故答案为:溶解;过滤;
(3)第④步中,相应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;BaCl2+Na2CO3=BaCO3↓+2NaCl;
(4)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度,
故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;
(5)配制250mL 0.2mol/L NaCl(精盐)溶液,由图可知未用玻璃棒引流、未采用250 mL容量瓶,故答案为:未用玻璃棒引流;未采用250 mL容量瓶.
点评 本题考查混合物分离提纯,为高频考点,把握粗盐提纯、物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.

练习册系列答案
相关题目
15.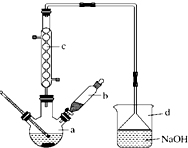 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴. 向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸水(干燥);
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C;(填入正确选项前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B.(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸水(干燥);
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C;(填入正确选项前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B.(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL.
12.化学反应N2(g)+3H2(g)═2NH3(l)的能量变化如图所示,则该反应的△H等于( )

| A. | +2(a-b-c) kJ•mol-1 | B. | +2(b-a) kJ•mol-1 | ||
| C. | +(b+c-a) kJ•mol-1 | D. | +(a+b) kJ•mol-1 |
19.已知:常温下浓度为0.1moL•L-的下列溶液的pH如下表.下列有关说法正确的是( )
| 溶质 | NaF | CH3COONa | Na2S |
| pH | 7.5 | 9.5 | 11.8 |
| A. | 根据如,NaF的水解程度比CH3COONa的大 | |
| B. | 同体积、同pH的两种酸溶液消耗同浓度NaOH的体积:HF>CH3COOH | |
| C. | 向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况):c(CH3COOH)+c(H+)═c(OH-)+c(F-) | |
| D. | 若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,则溶液中离子浓度大小为:c(Cl-)>c(HS-)>c(OH-)c(S2-)>c(H+) |
 W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:
W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答: