题目内容
13. W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:
W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:(1)Y基态原子的电子排布式是1s22s22p4;Y和W形成的三原子分子是非极性(填“极性”或“非极性”)分子.
(2)X与氢元素可形成的化合物XH3的中心原子杂化轨道类型为sp3杂化,XH3的立体构型是三角锥形.
(3)Z所在周期中第一电离能最大的主族元素Q名称氯元素.比较沸点高低:XY2<ZY.
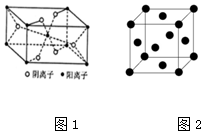
(4)Z与某元素形成的化合物的晶胞如图1所示,晶胞中阴离子与阳离子的个数比是2:1.
(5)R晶胞结构如图2所示,R晶体中每个R原子周围距离最近的R原子数目为12.
分析 W、X、Y、Z、R为前四周期元素,且原子序数依次增大,XY2是红棕色气体,为NO2,则X是N、Y是O元素;X与氢元素可形成NH3;
Z基态原子的M层与K层电子数相等,则Z为Mg元素;W是形成有机物种类最多的元素,为C元素;
R2+的3d轨道中有9个电子,则R原子核外电子数=2+8+17+2=29,为Cu元素;
(1)Y为O元素,其基态原子核外有8个电子,根据构造原理书写O基态原子的电子排布式;中心重合的分子为非极性分子,不重合的分子为极性分子;
(2)根据价层电子对互斥理论判断原子杂化方式及微粒空间构型;
(3)Z是Mg元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
熔沸点:离子晶体>分子晶体;
(4)利用均摊分计算该晶胞中阴阳离子个数之比;
(5)Cu晶胞为面心立方最密堆积,每个Cu原子周围距离最近的Cu原子数目=3×8÷2.
解答 解:W、X、Y、Z、R为前四周期元素,且原子序数依次增大,XY2是红棕色气体,为NO2,则X是N、Y是O元素;X与氢元素可形成NH3;
Z基态原子的M层与K层电子数相等,则Z为Mg元素;W是形成有机物种类最多的元素,为C元素;
R2+的3d轨道中有9个电子,则R原子核外电子数=2+8+17+2=29,为Cu元素;
(1)Y为O元素,其基态原子核外有8个电子,根据构造原理书写O基态原子的电子排布式为1s22s22p4;中心重合的分子为非极性分子,不重合的分子为极性分子,Y和W形成的三原子分子为CO2,是直线形分子,该分子中心重合,为非极性分子,
故答案为:1s22s22p4;非极性;
(2)NH3分子中N原子价层电子对个数是4且含有一个孤电子对,所以该分子中中心原子杂化轨道类型为sp3杂化,NH3的立体构型是三角锥形,故答案为:sp3;三角锥形;
(3)Z是Mg元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Mg位于第三周期,该周期中第一电离能最大的主族元素是氯元素;
熔沸点离子晶体>分子晶体,NO2是分子晶体、MgO是离子晶体,所以熔沸点XY2<ZY,
故答案为:氯元素;<;
(4)该晶胞中阳离子个数=1+8×$\frac{1}{8}$=2、阴离子个数=2+4×$\frac{1}{2}$=4,所以阴阳离子个数之比=4:2=2:1,
故答案为:2:1;
(5)Cu晶胞为面心立方最密堆积,每个Cu原子周围距离最近的Cu原子数目=3×8÷2.=12,
故答案为:12.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、元素周期律、原子核外电子排布、微粒空间构型判断等知识点,侧重考查学生推断、计算及空间想象能力,明确物质结构、原子结构及价层电子对互斥理论等知识点是解本题关键,注意(5)题的计算,为易错点.

 特高级教师点拨系列答案
特高级教师点拨系列答案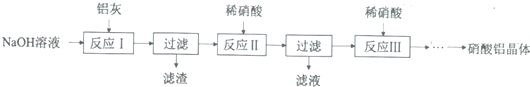
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
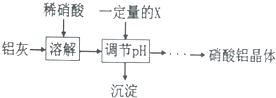
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
| A. | 用到的玻璃仪器有:玻璃棒、胶头滴管、500mL容量瓶、烧杯 | |
| B. | 需要称量氢氧化钠固体1.92g | |
| C. | 没有等溶液冷却就转移将导致所配溶液浓度偏高 | |
| D. | 洗净的容量瓶不需要干燥就能使用,但使用前需检漏 |
| A. | 2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023 | |
| B. | 标准状况下,22.4 L乙醇的共价键数为8×6.02×1023 | |
| C. | 标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023 | |
| D. | 100 mL 1 mol•L-1醋酸溶液中,H+的个数为0.1×6.02×1023 |
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)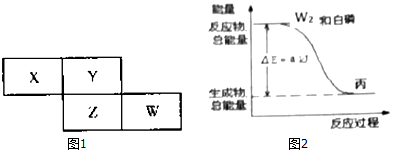
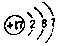 .
. .白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.
.白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol. .
.