题目内容
9.用18mol•L-1浓硫酸配制100mL 3.0mol•L-1稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④冷却
⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是16.7mL.
(2)第④步实验的操作是冷却.
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中偏小;
B.容量瓶用蒸馏水洗涤后残留有少量的水无影响;
C.定容时俯视刻度线偏大.
分析 (1)依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积;
(2)依据配制一定物质的量浓度溶液的一般步骤解答;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进程误差分析;
解答 解:(1)用18mol•L-1浓硫酸配制100mL 3.0mol•L-1稀硫酸,设需要浓硫酸体积V,则依据溶液稀释过程中所含溶质的物质的量不变得:18mol/L×V=100mL×3.0mol•L-1,解得V=16.7mL;
故答案为:16.7mL;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、稀释、冷却、移液、洗涤、定容、摇匀、装瓶贴标签;
故答案为:冷却;
(3)A.所用的浓硫酸长时间放置在密封不好的容器中,导致浓硫酸浓度降低,量取的浓硫酸中含硫酸的物质的偏小,溶液浓度偏小;
故答案为:偏小;
B.容量瓶用蒸馏水洗涤后残留有少量的水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不受影响;
故答案为:无影响;
C.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏大;
故答案为:偏大.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.

练习册系列答案
相关题目
19.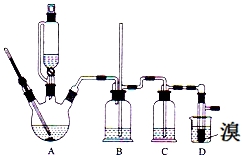 实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:
实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的需分两步进行,第二步反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填正确选项前的字母).
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:
实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的需分两步进行,第二步反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填正确选项前的字母).
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
20. S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
反应涉及的几种物质的熔沸点如下:
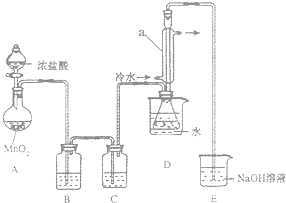
该小组设计的制备装置如图(夹持仪器已略去).
回答下列问题:
(1)连接好实验装置后的第一步实验操作是检查装置的气密性;
(2)实验中需要加热的仪器是AD(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸;
(4)装置D中仪器a的作用是冷凝回流、导气;
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏;
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
 S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
回答下列问题:
(1)连接好实验装置后的第一步实验操作是检查装置的气密性;
(2)实验中需要加热的仪器是AD(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸;
(4)装置D中仪器a的作用是冷凝回流、导气;
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏;
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
17.下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题.
(1)在①~⑧元素中化学性质最不活泼的元素的名称是氩,金属性最强的元素的名称是钠.
(2)③、④、⑥三种元素中的原子半径最小的是O(填元素符号).
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是Na+>Mg2+>Al3+(用离子符号填写).
(4)④与⑥形成的化合物的电子式为 .
.
(5)④与氢形成含氢量最高的化合物的结构式 .
.
(6)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(7)写出①、⑥和氢元素形成既含离子键又含共价键的化合物的电子式: ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(2)③、④、⑥三种元素中的原子半径最小的是O(填元素符号).
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是Na+>Mg2+>Al3+(用离子符号填写).
(4)④与⑥形成的化合物的电子式为
 .
.(5)④与氢形成含氢量最高的化合物的结构式
 .
.(6)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(7)写出①、⑥和氢元素形成既含离子键又含共价键的化合物的电子式:
 ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
14.除去下列物质中少量杂质(括号内为杂质),所用试剂或方法错误的是( )
| A. | NaCl固体(KNO3)溶解配成热饱和溶液、降温结晶 | |
| B. | CO(水蒸气)通过浓硫酸的洗气瓶 | |
| C. | CaO固体(CaCO3)高温煅烧 | |
| D. | KCl固体(MnO2)溶解、过滤、蒸发 |
18.在一定条件下,发生反应:2X(g)+Y(g)?Z(g)△H=-197kJ•mol-1,若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
19.下列各项实验操作中正确的是( )
| A. | 用酒精萃取溴水中溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 溶解固体时烧杯在使用前必须干燥 | |
| C. | 萃取、分液前需对分液漏斗检漏,分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸馏操作时,不可以用温度计搅拌,温度计水银球靠近蒸馏烧瓶的支管口处 |
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)