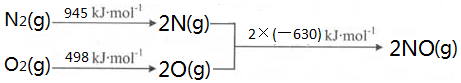
题目内容
3.X、Y、Z、R、M、N为六种短周期元素,其原子半径和最外层电子数之间的关系如下图一所示,用化学用用语答问题: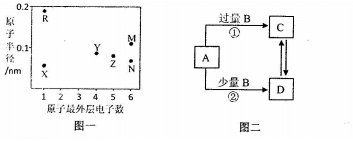
(1)Z在周期表中的位置第二周期ⅤA族;M的原子结构示意图
 .
.(2)比较R、N、M三种元素简单离子的半径由小到大的顺序Na+<O2-<S2-.
(3)化合物RYZ的电子式为
 ,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.
,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.(4)X和Y两种元素可以组成一种4原子气体分子,它的空间构型为直线型;已知常温下,1g 该物质完全燃烧放出akJ热量.写出表示该物质燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l))△H=-26akJ/mol.
(5)上图二转化关系中的A、B、C、D四种化合物均由上述六种元素中的若干种构成,其中B为气体.
①若C的溶液呈酸性,则C溶液中离子浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
②若C的溶液呈碱性,则C可能是NaHCO3或NaHS(写出一种即可).
分析 X、Y、Z、R、M、N为六种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M、N最外层有6个电子,位于第VIA族;
R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素、N为O元素,结合对应单质、化合物的性质以及元素周期律解答(1)~(4);
(5)上图二转化关系中的A、B、C、D四种化合物均由上述六种元素中的若干种构成,其中B为气体,可能为二氧化碳、二氧化硫、硫化氢等,则A可为NaOH.
①C为过量B反应生成,应为酸式盐,若C的溶液呈酸性,应为NaHSO3;
②若C的溶液呈碱性,则C可能是水解呈碱性的酸式盐,以此解答该题.
解答 解:(1)由以上分析可知Z为N元素,位于周期表第二周期ⅤA族,M为S元素,原子结构示意图为 ,
,
故答案为:第二周期ⅤA族; ;
;
(2)Na+、O2-具有相同的核外电子排布,核电荷数越大离子半径越小,则Na+<O2-,比其它两种离子多一个电子层,S2-离子半径最大,则应为Na+<O2-<S2-,
故答案为:Na+<O2-<S2-;
(3)化合物RYZ为NaCN,为离子化合物,含有C≡N,电子式为 ,它能与双氧水在酸性条件下反应,生成两种无毒气体,应生成二氧化碳和氮气,反应的离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O,
,它能与双氧水在酸性条件下反应,生成两种无毒气体,应生成二氧化碳和氮气,反应的离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O,
故答案为: ;2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O;
;2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O;
(4)H和C两种元素可以组成一种4原子气体分子,应为C2H2,为直线型分子;已知常温下,1g 该物质完全燃烧放出akJ热量,则1mol乙炔完全燃烧放出26akJ的热量,该物质燃烧热的热化学方程式为C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l))△H=-26akJ/mol,
故答案为:直线型;C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l))△H=-26akJ/mol;
(5)上图二转化关系中的A、B、C、D四种化合物均由上述六种元素中的若干种构成,其中B为气体,可能为二氧化碳、二氧化硫、硫化氢等,则A可为NaOH,C、D为酸式盐和正盐的转化.
①C为过量B反应生成,应为酸式盐,若C的溶液呈酸性,应为NaHSO3,呈酸性,说明HSO3-电离程度大于水解程度,因HSO3-部分电离和水解,则c(Na+)>c(HSO3-)>c(H+),溶液中存在HSO3-和水的电离,则c(H+)>c(SO32-),c(SO32-)略小于c(H+),则c(SO32-)>c(OH-),则溶液中离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
②若C的溶液呈碱性,则C可能是水解呈碱性的酸式盐,可为NaHCO3或NaHS,故答案为:NaHCO3或NaHS.
点评 本题综合考查元素周期表的位构性以及无机物的推断,为高考常见题型和高频考点,侧重考查学生的分析能力,本题注意把握原子的半径以及电子层的变化规律,把握相关物质的性质以及转化关系,学习中掌握电子式、热化学方程式的书写,加强基础知识的学习,难度中等.

| A. | 水浴加热 | B. | 将稀硫酸改为98%的浓硫酸 | ||
| C. | 滴加少许CuSO4溶液 | D. | 改用铁粉并振荡 |
| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物能是与化学反应无关的一种能源 | |
| C. | 化学能只能以热能的形式释放 | |
| D. | 葡萄糖在人体内的氧化是放热反应 |
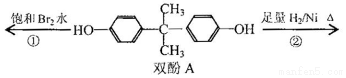
| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1mol双酚A最多消耗2mol Br2 | |
| C. | 反应②的产物中只有一种官能团 | |
| D. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 |
| A. | 溶剂的质量 | B. | 溶质的质量分数 | C. | KNO3的溶解度 | D. | 溶液中K+的数目 |
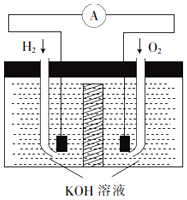 氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定. 为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案: