题目内容
20.下列仪器,常用于物质分离的是( )①漏斗 ②蒸发皿 ③托盘天平 ④分液漏斗 ⑤蒸馏烧瓶 ⑥量筒 ⑦燃烧匙.
| A. | ①②⑤⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑥⑦ |
分析 实验室常用于分离的操作有过滤、蒸发、蒸馏、萃取、分液等,常用的仪器有普通漏斗、分液漏斗、蒸馏烧瓶等仪器.
解答 解:①普通漏斗常用于过滤,可用来分离固液混合物;
②蒸发皿常用于蒸发,可用来分离固液混合物;
③托盘天平常用于称量固体的质量;
④分液漏斗常用于分离互不相溶的液体混合物;
⑤蒸馏烧瓶常用于分离沸点不同的液体混合物;
⑥量筒用于量取液体,一般不用于物质的分离;
⑦燃烧匙用于盛放固体进行燃烧,一般不用于物质的分离;
所以用来分离的仪器有①②④⑤.
故选B.
点评 本题考查实验室常见仪器的使用,题目难度不大,注意熟练掌握常见仪器的构造及其使用方法,试题注重了基础知识的考查,培养了学生灵活应用所学知识的能力.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
1.在氯化铁和氯化铜的混合溶液中,加入过量铁粉,完全反应后过滤,所得固体的质量与所加铁粉的质量相等,则原混合液中氯化铁和氯化铜的物质的量浓度之比是( )
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
11.生成两种一氯代烃的是( )
| A. | CH3CH2CH2CH2CH3 | B. |  | C. |  | D. |  |
8.下列化学用语书写正确的是( )
| A. | CO2的结构式为:O-C-O | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_{6}^{14}$C | |
| C. | 氯化镁的电子式: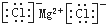 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
5. 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )| A. | 铁是阳极,电极反应为 Fe-6e-+4H2O=FeO42-+8H+ | |
| B. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| C. | 若隔膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- | |
| D. | 电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计) |
12.现有CuO和Fe2O3的混合物a g,向其中加入1.0mol/L的硝酸溶液200mL,恰好完全反应.若将2a g该混合物用足量CO还原,充分反应后剩余固体的质量为( )
| A. | (2a-1.6)g | B. | 2(a-1.6)g | C. | (a-1.6)g | D. | (2a-3.2)g |
9.一定条件子啊,化学反应处于平衡状态时,下列说法一定正确的是( )
| A. | 反应不再进行 | B. | 反应物浓度等于生成物浓度 | ||
| C. | 各组分浓度不再随时间而变化 | D. | 反应物的质量等于生成物的质量 |
10.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18g•mol-1 | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | 3.01×1023个NH3分子的质量为8.5g | |
| D. | CH4的摩尔质量为16g |
