题目内容
在一密闭容器中进行反应2SO2+O2?2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.3mol/L、0.15mol/L、0.3mol/L.当反应达到平衡时,可能存在的数据是( )
| A、SO2为0.6 mol/L,O2为0.3mol/L |
| B、SO2为0.4mol/L |
| C、SO3为0.6 mol/L |
| D、SO2、SO3均为0.2 mol/L |
考点:化学反应的可逆性
专题:化学平衡专题
分析:化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答:
解:A、O2、SO2浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则O2、SO2的浓度浓度变化为0.3mol/L、0.15mol/L,而实际变化小于该值,故A错误;
B、SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化分别为0.3mol/L而实际变化等于该值,可能为0.4mol/L,故B正确;
C、三氧化硫的浓度增大,但是二氧化硫和氧气不可能完全转化为三氧化硫,所以SO3达不到0.6 mol/L,故C错误;
D、反应物、生产物的浓度不可能同时增大,应一个减小,另一个一定增大,故D错误.
故选B.
B、SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化分别为0.3mol/L而实际变化等于该值,可能为0.4mol/L,故B正确;
C、三氧化硫的浓度增大,但是二氧化硫和氧气不可能完全转化为三氧化硫,所以SO3达不到0.6 mol/L,故C错误;
D、反应物、生产物的浓度不可能同时增大,应一个减小,另一个一定增大,故D错误.
故选B.
点评:本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
相关题目
含有下列哪种分子或离子的试剂加入到含有Br-的溶液中可将Br-氧化为Br2( )
| A、I2 |
| B、I- |
| C、Cl2 |
| D、Cl- |
下列说法正确的是( )
| A、3p3表示3p能级有三个轨道 |
| B、同一原子中,2p、3p、4p能级的轨道数依次增多 |
| C、冰和固体碘晶体中的相互作用力不相同 |
D、 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
钢铁腐蚀发生得最普遍的是( )
| A、化学腐蚀 | B、析氢腐蚀 |
| C、吸氧腐蚀 | D、摩擦 |
化学已渗透到人类生活的各个方面.下列说法不正确的是( )
| A、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| B、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| C、可采用将外加电源的正极连接水电站的钢铁闸门上的方式来保护闸门不生锈 |
| D、禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
下列有关化学用语正确的是( )
A、中子数为18的氯原子结构示意图: | ||
B、质量数为37的氯原子:
| ||
C、Cl-的结构示意图: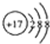 | ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |