题目内容
设反应C(s)+CO2(g)═2CO(g)(正反应吸热),正反应速率为v1;N2(g)+3H2(g)═2NH3(g)(正反应放热),正反应速率为v2.对于上述反应,当温度升高时,v1和v2的变化情况为( )
| A、v1增大、v2减小 |
| B、同时减小 |
| C、同时增大 |
| D、v1减小、v2增大 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据温度对反应物中活化分子的影响,分析化学反应速率的变化.
解答:
解:升高温度,增大了反应物中活化分子百分数,使有效碰撞几率增大,反应速率增大;所以当温度升高时,吸热反应和放热反应的反应速率都增大,故C正确;
故选C.
故选C.
点评:本题考查了温度对化学反应速率的影响,题目比较简单,属于基本理论的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质中,可以作为食品防腐剂的是( )
| A、碳酸氢钠 | B、L-谷氨酸钠 |
| C、苯甲酸钠 | D、乳酸 |
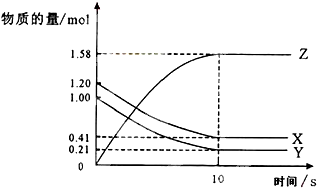 一定温度下,在2L的密闭容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示下列描述正确的是( )
一定温度下,在2L的密闭容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示下列描述正确的是( )| A、反应开始到10 s,用Z表示的反应速率为0.158 mol/(L?s) |
| B、反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C、反应开始到10 s时,Y的转化率为79% |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
下列分子式表示的物质,具有同分异构体的是( )
| A、C3H6 |
| B、C3H8 |
| C、CH2Cl2 |
| D、C2H4 |
在给定的溶液中,加入对应的一组离子,则该组离子能在原溶液中大量共存的是( )
| A、滴加甲基橙显红色的溶液:I-、NH4+、Cl-、NO3- |
| B、含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- |
| C、常温下由水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D、含有溶质为NaHSO4的溶液:K+、SiO32-、NO3-、Al3+ |
 3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )
3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )| A、图中C表示生成物NH3(g)的总能量 |
| B、断裂3molH-H和1mol N≡N所吸收的总能量大于形成6mol N-H所释放的总能量 |
| C、逆反应的活化能E(逆)=E+△H |
| D、3 H2(g)+N2(g)?2NH3(g)△H<0 |
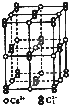 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题: