题目内容
11.下列实验现象中,与氧化还原反应无关的是( )| A. | 碳酸钠溶液中加入氯化钙溶液产生沉淀 | |
| B. | 铜粉在空气中加热变成黑色粉末 | |
| C. | 石灰石溶于盐酸并产生无色无味的气体 | |
| D. | 液氢在空气中变为氢气 |
分析 生活现象中涉及的化学反应中,若有元素的化合价变化,则反应为氧化还原反应,以此来解答.
解答 解:A.为复分解反应,与氧化还原反应无关,故A选;
B、铜在空气中生成黑色氧化铜,铜由0价变成+2价,故B不选;
C、石灰石溶于盐酸发生得分解生成二氧化碳,是非氧化还原反应,故C选;
D、物质三态改变是物理变化,故D选;
故选ACD.
点评 本题考查氧化还原反应,为高频考点,把握反应中的元素化合价变化为解答的关键,侧重氧化还原反应判断与生活中化学的联系的考查,题目难度不大.

练习册系列答案
相关题目
2.一定温度下的密闭容器中存在如下反应:H2(g)+I2(g)?2HI(g);已知c始(H2)=0.4mol•L-1,c始(I2)=1mol•L-1,经测定该反应在该温度下的平衡常数K=64,当H2转化率为50%时,下列结论正确的是( )
| A. | 该反应达到平衡状态 | |
| B. | 该反应正在向左方向进行 | |
| C. | 达平衡状态时,H2的转化率应为96.3% | |
| D. | 增大H2的量,该反应平衡常数将减小 |
19.已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
(1)反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4-5min原因是此时段c(H+)减小.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是置换出Cu,形成Cu-Zn原电池,使反应更快.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是置换出Cu,形成Cu-Zn原电池,使反应更快.
6.下列物质可用于治疗胃酸过多的是( )
| A. | 碳酸氢钠 | B. | 氢氧化铝 | C. | 氢氧化钠 | D. | 硫酸钡 |
3.下列有关元素周期律的叙述正确的是( )
| A. | 随着原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 元素周期律的实质是元素化合价呈周期性变化 |
20.下列生活中的一些现象发生了化学变化的是 ( )
| A. | 食物发霉 | B. | 冰雪融化 | C. | 铜像生锈 | D. | 聚沙成塔 |
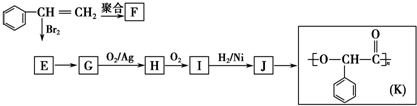
 ;I的结构简式是
;I的结构简式是 .
.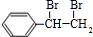 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$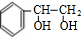 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.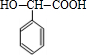 ;反应类型属于加成反应.
;反应类型属于加成反应. .
.