题目内容
17.镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤渣中含有( )| A. | Al(OH)3 | B. | Cu(OH)2 | C. | Mg(OH)2 | D. | Al2O3 |
分析 铜与盐酸不反应,加过量盐酸时Mg、Al反应,过滤后向滤液中含镁离子、铝离子子,加入过量烧碱溶液,镁离子转化为沉淀,只有铝离子转化为偏铝酸钠存在于滤液中,以此来解答.
解答 解:镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,Cu不反应,发生Mg+2H+=H2↑+Mg2+、2Al+6H+=3H2↑+2Al3+,
过滤后向滤液中加入过量氢氧化钠溶液,发生H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,镁转化生成沉淀,铝元素存在于AlO2-中,
加入过量的NaOH溶液,滤渣中含有Mg(OH)2,
故选C.
点评 本题考查金属及化合物的综合应用,为高频考点,明确发生的离子反应是解本题关键,注意金属活动性及两性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列溶液氯离子的物质的量浓度与50mL 1mol•L-1AlCl3溶液中氯离子的物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 3 mol•L-1氯化钙溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
5.下列说法正确的是( )
| A. | 22.4LN2含阿伏加德罗常数个氮分子 | |
| B. | 在标准状况下,11.2 L四氯化碳所含分子数为0.5NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA |
2.下列说法正确的是( )
| A. | 32gO2占有的体积为 22.4L | |
| B. | 22.4LN2 含有阿伏加德罗常数个 N2 | |
| C. | 在标准状况下,22.4L 水的物质的量为 1mol | |
| D. | 22gCO2 和 16gO2,在同温、同压下占有的体积相同 |
9.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯,后点燃 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
6.乙苯催化脱氢制苯乙烯反应: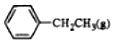 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$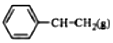 +H2O,己知:
+H2O,己知:
根据表中数据计算上述反应的△H(kJ•mol-1)( )
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ +H2O,己知:
+H2O,己知:| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
| A. | -124 | B. | +124 | C. | +1172 | D. | -1048 |
11.下列对氯气的叙述中正确的是( )
| A. | 能与所有金属反应 | B. | 具有氧化性 | ||
| C. | 不能支持燃烧 | D. | 具有漂白作用 |