题目内容
1.铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等,回答下列问题:(1)铅与碳是同族元素,则下列说法正确的是ad.
a.主要化合价为+2、+4
b.同族的Si与Ge(锗)均为半导体材料,铅也为半导体材料.
c.铅的最高价氧化物对应水化物的酸性强于碳酸
d.与同族的Ge(锗)作比较:碱性Ge(OH)4<Pb(OH)4,则金属性Ge<Pb,周期表中位置Pb在Ge下面.
e.同族的Ge(锗)与盐酸不反应,Pb与盐酸能反应,则原子半径Ge>Pb
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为PbO+ClO-=PbO2+Cl-.
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)△H=a kJ?mol-1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)△H=b kJ?mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)△H=c kJ?mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=2a+2b-3ckJ?mol-1(用含a,b,c的代数式表示).
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图1所示,该电池正极的电极反应式为PbSO4+2e-=SO42-+Pb.
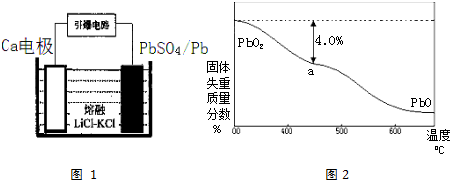
(5)PbO2在加热过程发生分解的失重曲线如图2所示,已知失重曲线上的a点为样品失重4.0%[即:($\frac{样品起始质量-a点固体质量}{样品起始质量}$×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2•nPbO,列式计算x值1.4,和m:n值2:3.
分析 (1)a.铅与碳是同族元素,最外层电子数为4,主要化合价为+2、+4;
b.铅是金属不是半导体材料;
c.同主族最高价氧化物对应水化物形成的酸性减弱;
d.同主族从上到下金属性增强,形成最高价氢氧化物的碱性增强;
e.同族的Ge(锗)与盐酸反应,Pb与盐酸能反应,原子半径从上到下依次增大;
(2)PbO和次氯酸钠反应生成二氧化铅和氯化钠;
(3)根据盖斯定律书写目标热化学方程式;
(4)原电池电极反应方程式的书写,首先根据装置图,判断正负极,然后书写正极电极反应方程式;
(5)若a点固体组成表示为PbOx,根据PbO2$\frac{\underline{\;\;△\;\;}}{\;}$PbOx+$\frac{2-x}{2}$O2↑列方程计算x的值;若组成表示为mPbO2•nPbO,则O原子与Pb原子的比值为x,据此计算解答.
解答 解:(1)a.铅与碳是同族元素,最外层电子数为4,主要化合价为+2、+4,故a正确;
b.同族的Si与Ge(锗)均为半导体材料,铅是金属不是半导体材料,故b错误;
c.同主族最高价氧化物对应水化物形成的酸性减弱,铅的最高价氧化物对应水化物的酸性弱于碳酸,故c错误;
d.同主族从上到下金属性增强,形成最高价氢氧化物的碱性增强,与同族的Ge(锗)作比较:碱性Ge(OH)4<Pb(OH)4,则金属性Ge<Pb,周期表中位置Pb在Ge下面,故d正确;
e.同族的Ge(锗)与盐酸反应,Pb与盐酸能反应,则原子半径Ge<Pb,故e错误;
故答案为:ad;
(2)PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO-=PbO2+Cl-,故答案为:PbO+ClO-=PbO2+Cl-;
(3)已知:①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)=3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)△H=c kJ•mol-1
将①×2+②×2-③×3可得反应3PbS(s)+6O2(g)=3PbSO4(s)
根据盖斯定律△H=2△H1+2△H2-3△H3=(2a+2b-3c)kJ•mol-1
故答案为:2a+2b-3c;
(4)根据装置图,判断正极为PbSO4发生还原反应,故答案为PbSO4+2e-=SO42-+Pb,故答案为:PbSO4+2e-=SO42-+Pb;
(5)若a点固体组成表示为PbOx,根据PbO2$\frac{\underline{\;\;△\;\;}}{\;}$PbOx+$\frac{2-x}{2}$O2↑,$\frac{2-x}{2}$×32=239×4.0%,x=1.4;
若组成为mPbO2•nPbO,根据原子守恒得,O原子和Pb原子的比值=x=$\frac{2m+n}{m+n}$=1.4,得m:n=2:3,
故答案为:1.4;2:3;
点评 本题考查碳族元素性质,题目难度中等,涉及盖斯定律的应用、离子反应、电解原理等知识点,注意原电池原理、原子守恒、周期表中递变规律的分析应用.

①FeCl3②绿矾③碳酸氢钠 ④Na2SO3 ⑤KNO3 ⑥CaCl2 ⑦HCl.
| A. | ⑤⑥ | B. | ②③④⑤ | C. | ③⑤ | D. | ①③⑤ |
| A. | HCl电离产生H+和 Cl-,可判断HCl分子中存在离子键 | |
| B. | NaHSO4固体中含有的阴离子与阳离子的个数比为1:1 | |
| C. | 化学键是指使原子或离子相互结合的静电吸引作用力 | |
| D. | 不同元素组成的多原子分子中的化学键一定全是极性键 |
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2能使溴水褪色 | SO2具有还原性 |
| B | NH3能使酚酞溶液变红 | NH3可用于设计喷泉 |
| C | SiO2能与氢氟酸、碱反应 | SiO2是两性氧化物 |
| D | 晶体Si熔点高硬度大 | 晶体Si可用作半导体材料 |
| A. | A | B. | B | C. | C | D. | D |
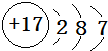
 ;
;