题目内容
11.下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银.
(1)属于复分解反应的放热反应的是①(用序号填空)
(2)属于吸热反应的是③(用序号填空)
(3)能设计成原电池的反应是②④(用序号填空)
(4)能设计成燃料电池的反应是②(用序号填空)
(5)写出③发生反应的化学方程式Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O写出④发生反应的离子方程式Cu+2Ag+═Cu2++2Ag.
分析 (1)复分解反应是两种化合物中的阴阳离子之间交换成分的反应;酸碱中和反应属于放热反应;
(2)铵盐和氢氧化钡晶体之间的反应是吸热反应;
(3)自发地氧化还原反应可以设计成原电池;
(4)物质的燃烧反应可以设计成原电池;
(5)Ba(OH)2•8H2O与NH4Cl的反应方程式为Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;金属铜和硝酸银之间发生置换反应得到金属铜和硝酸银.
解答 解:(1)氢氧化钠与硫酸之间的反应属于复分解反应,也是中和反应,也是放热的,故答案为:①;
(2)八水合氢氧化钡与氯化铵之间的反应是吸热反应,故答案为:③;
(3)②一氧化碳与氧气的燃烧反应可以设计成燃料电池,金属铜与硝酸银间发生置换反应得到金属铜和硝酸银,属自发的氧化还原反应,可以设计成原电池,故答案为:②④;
(4)一氧化碳与氧气的燃烧反应可以设计成燃料电池,故答案为:②;
(5)八水合氢氧化钡与氯化铵的反应是吸热反应,化学方程式为Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
金属铜和硝酸银之间发生置换反应得到金属铜和硝酸银,即Cu+2Ag+═Cu2++2Ag,故答案为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;Cu+2Ag+═Cu2++2Ag.
点评 本题考查学生复分解反应、置换反应类型的特点、原电池的构成条件以及反应式的书写等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象.请帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:仪器:试管、胶头滴管.
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容).
(4)实验结论:同主族元素从上到下元素原子的得电子能力逐渐减弱.
(5)问题和讨论.
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-=Br2+2Cl-、2I-+Br2=2Br-+I2.
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯的强:HF的稳定性比HCl强、F2能置换出水中的氧,而Cl2不能置换出水中的氧.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:仪器:试管、胶头滴管.
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容).
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈紫红色 |
(5)问题和讨论.
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-=Br2+2Cl-、2I-+Br2=2Br-+I2.
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯的强:HF的稳定性比HCl强、F2能置换出水中的氧,而Cl2不能置换出水中的氧.
16.广泛存在于装修材料和胶合板、涂料中且家庭装修中空气污染源之首的一种有机物是( )
| A. | 二氧化碳 | B. | 二氧化氮 | C. | 氮气 | D. | 甲醛 |
3.下面四种有机物中在核磁共振氢谱图有一个吸收峰是( )
| A. | CH2=CH-CH3 | B. | CH3CH2CH3 | C. | CH4 | D. | CH3CH2OH |
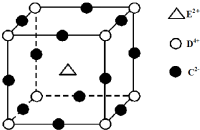 周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.
周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.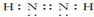 .
.