题目内容
室温下向10mL c(H+)=10-3 mol?L-1的醋酸溶液中加水稀释后,下列说法正确的是( )
| A、溶液中导电粒子的数目减少 | ||
B、溶液中
| ||
| C、醋酸的电离程度增大,c(OH-)亦增大 | ||
| D、再加入10 mL c(OH-)=10-3 mol?L-1的NaOH溶液,醋酸与NaOH恰好完全反应 |
考点:弱电解质在水溶液中的电离平衡
专题:高考化学专题,电离平衡与溶液的pH专题
分析:A、加水稀释,醋酸的电离平衡正向移动,溶液中离子数目增多,因此溶液中导电粒子的数目增多;
B、加水稀释,溶液中各粒子浓度同等程度减小,但因醋酸的电离平衡正向移动,使溶液中c(CH3COO-)减小的程度小于c(CH3COOH)减小的程度;
C、温度不变,溶液中Kw不变,c(H+)减小则c(OH-)亦增大;
D、NaOH是强电解质,加入10 mL c(OH-)=10-3 mol?L-1的NaOH溶液后只能恰好中和醋酸溶液中醋酸电离出的H+,因此反应后醋酸有剩余.
B、加水稀释,溶液中各粒子浓度同等程度减小,但因醋酸的电离平衡正向移动,使溶液中c(CH3COO-)减小的程度小于c(CH3COOH)减小的程度;
C、温度不变,溶液中Kw不变,c(H+)减小则c(OH-)亦增大;
D、NaOH是强电解质,加入10 mL c(OH-)=10-3 mol?L-1的NaOH溶液后只能恰好中和醋酸溶液中醋酸电离出的H+,因此反应后醋酸有剩余.
解答:
解:A、加水稀释,醋酸的电离平衡正向移动,溶液中离子数目增多,因此溶液中导电粒子的数目增多,故A错误;
B、加水稀释,醋酸的电离平衡正向移动,溶液中c(CH3COO-)减小的程度小于c(CH3COOH)减小的程度,因此溶液中
变大,故B正确;
C、加水稀释,醋酸的电离平衡正向移动,醋酸的电离程度增大、溶液酸性减弱,c(H+)减小,因溶液中Kw不变,故c(OH-)亦增大,故C正确;
D、醋酸存在电离平衡,因此再加入10 mL c(OH-)=10-3 mol?L-1的NaOH溶液,醋酸电离出H+恰好与NaOH完全反应,反应后醋酸有剩余,故D错误.
故选BC.
B、加水稀释,醋酸的电离平衡正向移动,溶液中c(CH3COO-)减小的程度小于c(CH3COOH)减小的程度,因此溶液中
| c(CH3COO-) |
| c(CH3COOH) |
C、加水稀释,醋酸的电离平衡正向移动,醋酸的电离程度增大、溶液酸性减弱,c(H+)减小,因溶液中Kw不变,故c(OH-)亦增大,故C正确;
D、醋酸存在电离平衡,因此再加入10 mL c(OH-)=10-3 mol?L-1的NaOH溶液,醋酸电离出H+恰好与NaOH完全反应,反应后醋酸有剩余,故D错误.
故选BC.
点评:本题考生容易忽视稀释过程中溶液中Kw不变而漏选C项.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
化学与科学、技术、社会和环境密切相关.下列有关说法中错误的是( )
| A、对废旧电池进行回收处理,主要是为了环境保护和变废为宝 |
| B、用电解水的方法制取大量H2,可以缓解能源不足的问题 |
| C、大力开发和应用氢能源有利于实现“低碳经济” |
| D、工业上,不能采用电解MgCl2溶液的方法制取金属镁 |
等量的四份盐酸分别与足量的下列物质完全反应后,所得溶液浓度最小的是( )
| A、Mg |
| B、MgO |
| C、MgCO3 |
| D、Mg(OH)2 |
下列反应中属于氧化还原反应的是( )
| A、SO3+H2O=H2SO4 | ||||
| B、CaCO3+2HCl=CaCl2+H2O+CO2↑ | ||||
| C、Cl2+H2O=HCl+HClO | ||||
D、2NaHCO3
|
25℃时,甲、乙、丙三个烧杯分别盛有25mL、浓度均为0.10mol?L-1的醋酸、氢氧化钠溶液和醋酸钠溶液.下列说法正确的是( )
| A、乙溶液和丙溶液混合后,Na+浓度仍为0.10mol?L-1 |
| B、甲溶液和乙溶液混合后所得溶液的pH和丙溶液相同 |
| C、若甲与丙两溶液混合后溶液显酸性,则c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
| D、将丙溶液加到甲溶液中,则CH3COOH的电离平衡常数Ka变小 |
 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )| A、正硼酸晶体中只存在氢键 |
| B、H3BO3分子的稳定性与氢键无关 |
| C、分子中硼原子最外层为8e-稳定结构 |
| D、含1molH3BO3的晶体中有6mol氢键 |
下列有关物质性质的叙述正确的是( )
| A、MgO和Fe3O4都能与铝发生铝热反应 |
| B、乙醇和乙酸都能发生取代反应 |
| C、乙烷和苯都不能发生氧化反应 |
| D、NaCl溶液和蛋白质溶液都不能产生丁达尔效应 |
关于氯气及氯水的叙述中,下列正确的是( )
| A、纯净的氯气是一种黄绿色、有毒的气体,具有漂白性 |
| B、可用干燥的石蕊试纸验证氯水是否变质 |
| C、氯气能与铁反应,液氯不宜贮存在钢瓶中 |
| D、氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物 |
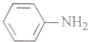 )具有
)具有
 转化为
转化为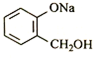 ,则应加入
,则应加入