题目内容
下列说法,正确的是( )
| A、最外层电子数为2的原子一定比最外层电子数为3的原子容易失去电子 |
| B、元素的非金属性越强最高价氧化物对应的水化物酸性越强 |
| C、ⅠA族元素都是碱金属元素 |
| D、元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制农药 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:A.He原子核外只有2个电子,为稳定结构;
B.元素的非金属性越强最高价氧化物对应的水化物酸性越强;
C.ⅠA族变化氢元素与碱金属元素;
D.在元素周期表中金属元素与非金属元素的分界线附近寻找半导体材料.
B.元素的非金属性越强最高价氧化物对应的水化物酸性越强;
C.ⅠA族变化氢元素与碱金属元素;
D.在元素周期表中金属元素与非金属元素的分界线附近寻找半导体材料.
解答:
解:A.He原子核外只有2个电子,为稳定结构,故A错误;
B.元素的非金属性越强最高价氧化物对应的水化物酸性越强,故B正确;
C.ⅠA族变化氢元素与碱金属元素,故C错误;
D.元素周期表中金属元素与非金属元素的分界线附近的一些元素具有一定的金属性与非金属性,可以寻找半导体材料,在右上角非金属性较强的区域寻找制备农药的元素,故D错误,
故选B.
B.元素的非金属性越强最高价氧化物对应的水化物酸性越强,故B正确;
C.ⅠA族变化氢元素与碱金属元素,故C错误;
D.元素周期表中金属元素与非金属元素的分界线附近的一些元素具有一定的金属性与非金属性,可以寻找半导体材料,在右上角非金属性较强的区域寻找制备农药的元素,故D错误,
故选B.
点评:本题考查元素周期表与元素周期律的应用,比较基础,注意对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4C1、③CH3COONH4、④NH3?H20,c(NH4+)由大到小的顺序是:①>②>③>④ |
| B、某溶液中由水电离出的c( H+)=1×l0-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、常温下,向AgCl悬浊液中加入少量NaC1固体后振荡,c(Cl-)增大,Ksp(AgCl)增大 |
| D、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是① ②
② ③
③ ④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
 ②
② ③
③ ④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )
④HC≡CCH3 ⑤CH3CH2CH3 ⑥CH3CH=CHCH3( )| A、①和② | B、①和③ |
| C、①和④ | D、③和⑥ |
下列各物质中,属于电解质且溶于水后溶液呈酸性的是( )
| A、HNO3 |
| B、NaOH |
| C、NH3 |
| D、Na |
解释下列事实的方程式正确的是( )
| A、加热可增强纯碱溶液去污力:CO32-+2H2O═H2CO3+2OH- |
| B、用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3-═Ag++NO↑++2H2O |
| C、向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2═2CO2+2CaSO4 |
| D、碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-═CaCO3↓+H2O |





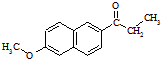 )外,最可能生成的副产物(与G互为同分异构体)的结构简式为
)外,最可能生成的副产物(与G互为同分异构体)的结构简式为 )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式: 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).