题目内容
6.下列各组物质中,互为同分异构体的是( )| A. | O2和O3 | B. | ${\;}_{17}^{35}Cl$和${\;}_{17}^{37}Cl$ | ||
| C. | CH3CH2CH2CH3和  | D. | C2H6和C3H8 |
分析 根据同分异构体是指分子式相同,但结构不同的化合物来解答.
解答 解:A、O2与O3是氧元素的不同单质,互称同素异形体,不是同分异构体,故A错误;
B、${\;}_{17}^{35}Cl$和${\;}_{17}^{37}Cl$是质子数相同,中子数不同的同一元素,互称同位素,不是同分异构体,故B错误;
C、CH3CH2CH2CH3和  是分子式相同,结构不同的化合物,属于同分异构体,故C正确;
是分子式相同,结构不同的化合物,属于同分异构体,故C正确;
D、C2H6和C3H8都是烷烃,结构相似,在分子组成上相差1个CH2原子团,属于同系物,不是同分异构体,故D错误;
故选C.
点评 本题考查了化学基本概念,难度不大,明确这几个概念的区别是解本题的关键.

练习册系列答案
相关题目
16.如图是X、Y、Z三种液体的对应近似pH,下列判断不正确的是( )

| A. | X显酸性 | B. | Y一定是水 | ||
| C. | Z可能是碳酸钠溶液 | D. | Z可使石蕊试液变蓝 |
14. 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
(3)下列说法正确的是BCD.
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
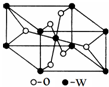
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
1.为鉴别卤代烃中所含卤素原子,现有下列实验操作步骤,正确的顺序是( )
①加入AgNO3溶液 ②加入少许卤代烃试样 ③加热 ④加入5mL 4mol•L-1 NaOH溶液 ⑤加入5mL 4mol•L-1 HNO3溶液.
①加入AgNO3溶液 ②加入少许卤代烃试样 ③加热 ④加入5mL 4mol•L-1 NaOH溶液 ⑤加入5mL 4mol•L-1 HNO3溶液.
| A. | ②④③①⑤ | B. | ②③①④⑤ | C. | ②④③⑤① | D. | ②⑤③①④ |
18.化学与生产、生活、社会密切相关.下列有关说法正确的是( )
| A. | 福尔马林可用作食品的保鲜剂 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
20.下列有机反应中,与其它三个反应类型不同的是( )
| A. |  | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 2C2H5OH→C2H5-O-C2H5+H2O | |
| D. |  |
