题目内容
2.把10.26g 由Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成200mL溶液,其中c(Na+)=0.4mol•L-1.则原固体混合物中Na2CO3•10H2O和NaHCO3的物质的量之比是( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 2:1 |
分析 设出Na2CO3•10H2O和NaHCO3的物质的量分别为x、y,分别根据二者总质量、钠离子的物质的量列式计算即可.
解答 解:设Na2CO3•10H2O和NaHCO3的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{286x+84y=10.26}\\{2x+y=0.4×0.2}\end{array}\right.$
解得:$\left\{\begin{array}{l}{x=0.03mol}\\{y=0.02mol}\end{array}\right.$
则原固体混合物中Na2CO3•10H2O和NaHCO3的物质的量之比=0.03mol:0.02mol=3:2,
故选C.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应实质即可解答,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.下列有关实验装置,能达到实验目的是( )

| A. | 用图1所示装置制取少量Cl2 | B. | 用图2所示装置制取干燥的NH3 | ||
| C. | 用图3制备并检验H2的可燃性 | D. | 用图4装置鉴别碳酸钠和碳酸氢钠 |
17.下列有关物质的分类正确的是( )
| A. | HD属于化合物 | B. | 纯碱属于碱 | ||
| C. | 胶体都属于混合物 | D. | CO属于酸性氧化物 |
14.下列说法中,正确的是( )
| A. | 乙醇和乙醚互为同分异构体 | |
| B. | 乙醇和乙二醇互为同系物 | |
| C. | 含羟基的化合物一定属于醇类 | |
| D. | 等质量的乙醇、乙二醇与足量钠反应时,乙二醇产生的氢气的量较乙醇的多 |
11.某溶液中通人NO2仍能大量共存的离子是( )
| A. | Ag+、Na+、CO32- | B. | H+、Fe2+、Cl- | C. | Cu2+、H+、SO42- | D. | Ba2+、H+、SO42- |
12.下列说法中正确的是( )
| A. | 植物油和裂化汽油都能使溴水褪色 | |
| B. | 葡萄糖、蔗糖都能与新制的Cu(OH)2悬浊液发生氧化反应 | |
| C. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔沸点 |
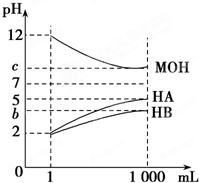 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
 .
.