题目内容
13.下列过程都与热量变化有关,其中叙述正确的是( )| A. | Ba(OH)2•8H2O与NH4Cl常温下混合就能反应,故该反应放热 | |
| B. | 已知2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ•mol-1,故H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 已知 H+(aq)+OH-(aq)═H2O-(l)△H=-57.31 kJ•mol-1,故 Ba2+(aq)+H+(aq)+OH- (aq)+SO42- (aq)=H2O(1)+BaSO4(s)△H<-57.31 kJ•mol-1 | |
| D. | 由图4可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2 |
分析 A.Ba(OH)2•8H2O与NH4Cl为吸热反应;
B.1mol可燃物燃烧生成稳定氧化物放出的热量为燃烧热;
C.中和反应为放热反应,且生成硫酸钡放热;
D.由图4可知,金刚石的能量比石墨的能量高.
解答 解:A.Ba(OH)2•8H2O与NH4Cl为吸热反应,反应条件与吸热、放热无关,故A错误;
B.1mol可燃物燃烧生成稳定氧化物放出的热量为燃烧热,由2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ•mol-1,水为气态,故H2的燃烧热不是241.8 kJ•mol-1,故B错误;
C.中和反应为放热反应,且生成硫酸钡放热,则Ba2+(aq)+H+(aq)+OH- (aq)+SO42- (aq)=H2O(1)+BaSO4(s)△H<-57.31 kJ•mol-1,故C正确;
D.由图4可知,金刚石的能量比石墨的能量高,则反应C(金刚石,s)=C(石墨,s)的焓变△H=△H2-△H1,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应物能量变化、燃烧热与中和热为解答本题关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
相关题目
3.下列化学用语或图示表达不正确的是( )
| A. | CO2的电子式: | B. | NH3的结构式为  | ||
| C. | CH4的比例模型: | D. | Clˉ离子的结构示意图: |
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 将0.1 mol CO2通入足量NaOH溶液,则溶液中阴离子数目为0.1 NA | |
| B. | 标准状况下,将11.2 L的Cl2通入足量的NaOH溶液中,转移的电子数为NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA |
18.反应速率V和反应物浓度的关系是用实验的方法测定的,化学反应:H2+Cl2=2HCl的反应速率V可以表示为:v=k•Cm(H2)•Cn(Cl2),式中的k为常数,m和n的值以可用下列表中数据确定之.由此可以推得,m和n的值正确的是( )
| H2(mol/L) | Cl2(mol/L) | V(mol/L•S) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1,n=2 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=1,n=$\frac{1}{2}$ | D. | m=$\frac{1}{2}$,n=1 |
5.某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成.某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如图所示:下列说法正确的是( )

| A. | 气体A是SO2和CO2的混合气体 | |
| B. | 固体A一定含有SiO2,可能含有BaSO4 | |
| C. | 该固体混合物中Fe2O3和Fe至少有其中一种 | |
| D. | 该固体混合物一定含有Fe、Na2SO3、BaCl2 |
2.下列关于铝及其化合物叙述中,正确的是( )
| A. | 不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 | |
| B. | 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定 | |
| C. | 铝和NaOH溶液反应:Al+2OH-═Al-+2H2↑ | |
| D. | 纯铝比铝合金的硬度更大、熔点更低 |
3.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 14g分子式为CnH2n的烃中含有的C-H键的数目一定为2NA | |
| B. | 1mol Fe与水蒸气反应生成的氢气为22.4L | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| D. | 0.1mol H2S分子中含氢离子数目为0.2 NA |

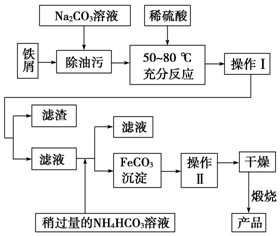 铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题: