题目内容
12.下列离子反应方程式正确的是( )| A. | NaHSO3水解:HSO3-+H2O?SO32-+H3O+ | |
| B. | 向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S+2Cl- | |
| C. | AlCl3溶液中滴加浓氨水至过量:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ |
分析 A.亚硫酸氢根离子水解生成亚硫酸和氢氧根离子;
B.氯化银与硫化钠反应生成硫化银和氯化钠;
C.不符合反应客观事实,二者反应生成氯化铵和氢氧化铝沉淀;
D.醋酸为弱酸保留化学式;
解答 解:A.NaHSO3水解,离子方程式:HSO3-+H2O?H2SO3+OH-,故A错误;
B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色,离子方程式:2AgCl+S2-═Ag2S+2Cl-,故B正确;
C.AlCl3溶液中滴加浓氨水至过量,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.白醋除铁锈,离子方程式:Fe2O3+6CH3COOH═3H2O+2Fe3++6CH3COO-,故D错误;
故选:B.
点评 本题考查了离子方程式书写正误判断,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
2.下列有关元素周期律的叙述中,正确的是( )
| A. | 酸性强弱:H3PO4<H2SO4 | B. | 金属性强弱:K<Na | ||
| C. | 碱性强弱:NaOH<Mg(OH)2 | D. | 原子半径:Cl>S |
3.W、X、Y、Z、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是( )

| A. | 原子半径:Y>Z>W | |
| B. | 单质的还原性:X>Y | |
| C. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 | |
| D. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 |
20.在含Na2CO3和NaHCO3各1mol的混合溶液中加入0.5mol下列物质,其中能使HCO3-的数目均减少,CO32-数目增加的是( )
| A. | 浓盐酸 | B. | Na2SO4浓溶液 | C. | NaOH浓溶液 | D. | Ba(OH)2浓溶液 |
17.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 将1mol明矾晶体完全溶于水制成胶体,其中所含胶体粒子数目为NA | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA | |
| C. | 0.1 mol•Lˉ1 CaCl2溶液中含有Clˉ离子的数目为0.2NA | |
| D. | 136g熔融的KHSO4中含有2NA个阳离子 |
4.化学试剂不变质和实验方法科学是化学实验成功的保障.下列试剂保存方法或实验方法中,不正确的是( )
| A. | 实验室中金属钠通常保存在煤油里 | |
| B. | 液溴易挥发,在存放液溴的试剂瓶中应加水封 | |
| C. | 保存FeCl3溶液时,通常在溶液中加少量的单质铁 | |
| D. | 浓硝酸通常保存在棕色试剂瓶中,置于阴凉处 |
1.下列物质既可以做防腐剂,又可以做调味剂的是( )
| A. | 食盐 | B. | 亚硝酸钠 | C. | 柠檬黄 | D. | 味精 |
2. 在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )
在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )
 在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )
在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )| A. | 曲线a代表的是Zn的反应,曲线b代表的是Mg的反应 | |
| B. | 两个反应分别在2min、3min时达到化学平衡 | |
| C. | Mg和Zn的反应速率之比为3:2 | |
| D. | 用Fe代替Zn,其他条件不变,绘出的图象完全相同 |
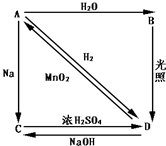 常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示