题目内容
20.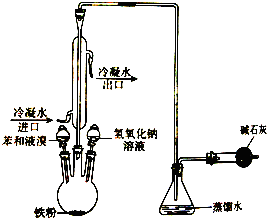 如图是实验室制取溴苯的装置图,请回答下列问题:
如图是实验室制取溴苯的装置图,请回答下列问题:(1)三颈瓶内发生的化学反应方程式是

(2)导管出口附近能发现的现象是导气管口处形成白雾
(3)导管口不能插入锥形瓶中的液面之下,原因是HBr极易溶于水,防止倒吸
(4)采用冷凝管的作用是将挥发出的反应物蒸气冷凝使其回流到反应容器中,干燥管的作用是吸收尾气
(5)反应结束向三颈瓶中加入氢氧化钠溶液,作用是除去溴苯中Br2等杂质.
分析 由制备实验装置可知,三颈瓶内苯与液溴发生取代反应生成溴苯,冷凝管可使苯、溴冷凝、回流,使反应物尽可能反应,锥形瓶内导管在液面上,可防止生成物溶于水倒吸,最后碱石灰可吸收溴,减少尾气的排放,以此来解答.
解答 解:(1)苯与液溴在催化剂条件下发生取代反应,即 ,故答案为:
,故答案为: ;
;
(2)溴与苯发生取代反应生成溴苯与溴化氢,反应放热溴化氢蒸出,与锥形瓶中的水蒸气结合成白雾,故答案为:导气管口处形成白雾;
(3)导管口不能插入锥形瓶中的液面之下,其原因是HBr极易溶于水,防止倒吸,故答案为:HBr极易溶于水,防止倒吸;
(4)采用冷凝管的作用是将挥发出的反应物蒸气冷凝使其回流到反应容器中;干燥管的作用是吸收尾气,故答案为:将挥发出的反应物蒸气冷凝使其回流到反应容器中;吸收尾气;
(5)反应结束后,向三颈烧瓶中加入NaOH溶液,与剩余的溴反应,除去杂质;
故答案为:除去溴苯中Br2等杂质.
点评 本题考查有机物制备实验,为高频考点,把握制备实验原理、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
10.等质量的下列物质在常温常压下体积最大的是( )
| A. | 浓硫酸 | B. | CO2 | C. | 铁粉 | D. | 冰水混合物 |
11.已知:2CO2(g)+6H2(g) $\stackrel{催化剂}{?}$ CH3CH2OH(g)+3H2O(g),某些化学键的键能数据如下表:
反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的焓变△H=-178 kJ•mol-1,△S<0(填>,<,=)
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
8.三种常见元素结构信息如下表,试根据信息回答有关问题:
(1)写出B原子的基态电子排布式1s22s22p63s23p4;
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键N-H…N-N-H…O-O-H…N-O-H…O-;A的氢化物分子结合一个H+形成阳离子后,其键角变大(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,
(4)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图
可简单表示如图1:
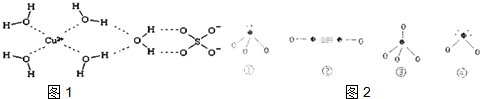
则胆矾晶体中含有ABCE
A.配位键 B.离子键 C.极性共价键 D.金属键 E.氢键F.非极性共价键
(5)下列分子结构图2中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.在以上分子中,中心原子采用sp3杂化形成化学键是①③④(填写序号).
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键N-H…N-N-H…O-O-H…N-O-H…O-;A的氢化物分子结合一个H+形成阳离子后,其键角变大(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,
(4)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图
可简单表示如图1:

则胆矾晶体中含有ABCE
A.配位键 B.离子键 C.极性共价键 D.金属键 E.氢键F.非极性共价键
(5)下列分子结构图2中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.在以上分子中,中心原子采用sp3杂化形成化学键是①③④(填写序号).
5.下列盛液体的仪器加热时,不需要用石棉网的是( )
| A. | 锥形瓶 | B. | 蒸馏烧瓶 | C. | 烧杯 | D. | 蒸发皿 |
12.下列物质的性质与氢键无关的是( )
| A. | 冰的密度比液态水的密度小 | B. | NH3易液化 | ||
| C. | NH3比PH3分子稳定 | D. | 乙醇以任意比例溶于水 |
9.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 在pH=1溶液中:NH4+、Fe2+、NO3-、Cl- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:AlO2-、K+、CO32-、Na+ | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32- | |
| D. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
1.下列各化合物的命名中正确的是( )
| A. | 2-甲基-2-丁炔 | B. | 2-乙基丁烷 | C. | 3-丁醇 | D. | 2-甲基-2-丁烯 |
 ;[Fe(C2O4)3]3-的名称是三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根).
;[Fe(C2O4)3]3-的名称是三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根).