题目内容
12.下列物质的性质与氢键无关的是( )| A. | 冰的密度比液态水的密度小 | B. | NH3易液化 | ||
| C. | NH3比PH3分子稳定 | D. | 乙醇以任意比例溶于水 |
分析 氢键的存在,影响到物质的某些性质.如熔点、沸点,溶解度,粘度,密度.
解答 解:A、冰和水的密度不同主要是由于水分子间存在氢键,氢键在水液态是使一个水分子与4个水分子相连,而当水凝固时氢键会拉伸水分子 使水分子之间距离增大 体积也就增大了,密度也就小了,故A正确;
B、氨气内部存在氢键(分子间的一种作用力),使得其熔沸点升高,所以氨气容易液化,故B正确;
C、由于N的非金属性大于P,所以NH3分子比PH3分子稳定,故C错误;
D、乙醇与水分子间存在氢键,所以乙醇以任意比例溶于水,故D正确;
故选:C.
点评 本题需要注意的是氢键的存在,影响到物质的熔点、沸点,溶解度,粘度,密度.而非金属性强弱只影响分子的稳定性,不影响沸点.

练习册系列答案
相关题目
2.下列不属于有机物的是( )
| A. | C6H6 | B. | 尿素 | C. | 醋酸 | D. | CaC2 |
3.下列各种微粒的表示方法中,不正确的是( )
| A. | 碳-12的原子符号:12 6C | |
| B. | 次氯酸分子的结构式:H-O-Cl | |
| C. | 硫离子的电子排布式为:1s22s22p63s23p6 | |
| D. | 二氧化硅的分子式:SiO2 |
4.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的分子式是:KOH.
(3)用电子式表示元素④与⑥的化合物的形成程: ,该化合物属于离子化合物(填“共价”或“离子”).
,该化合物属于离子化合物(填“共价”或“离子”).
(4)由②和氢元素按原子个数比1:3形成的化合物的电子式是 ,该化合物含的化学键类型是共价键.
,该化合物含的化学键类型是共价键.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的分子式是:KOH.
(3)用电子式表示元素④与⑥的化合物的形成程:
 ,该化合物属于离子化合物(填“共价”或“离子”).
,该化合物属于离子化合物(填“共价”或“离子”).(4)由②和氢元素按原子个数比1:3形成的化合物的电子式是
 ,该化合物含的化学键类型是共价键.
,该化合物含的化学键类型是共价键.
1.20℃、101kPa时,20L的下列气体中质量最大的是( )
| A. | N2 | B. | O2 | C. | CO2 | D. | CH4 |
 如图是实验室制取溴苯的装置图,请回答下列问题:
如图是实验室制取溴苯的装置图,请回答下列问题:
 ,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: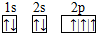 .
.