题目内容
11.已知:2CO2(g)+6H2(g) $\stackrel{催化剂}{?}$ CH3CH2OH(g)+3H2O(g),某些化学键的键能数据如下表:| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
分析 △H=反应物的总键能-生成物的总键能,该反应中气体的化学计量数之和1+3>1+1,以此来解答.
解答 解:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的焓变△H=750kJ/mol×2+436kJ/mol×3-(413kJ/mol×3+358kJ/mol+463kJ/mol)-463kJ/mol×2=-178kJ/mol;
该反应中气体的化学计量数之和1+3>1+1,混乱度减小,则△S<0,
故答案为:-178kJ/mol;<.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系、气体的化学计量数与熵变的关系等为解答的关键,侧重分析与应用能力的考查,注意化学键数目的判断,题目难度不大.

练习册系列答案
相关题目
2.下列不属于有机物的是( )
| A. | C6H6 | B. | 尿素 | C. | 醋酸 | D. | CaC2 |
3.下列各种微粒的表示方法中,不正确的是( )
| A. | 碳-12的原子符号:12 6C | |
| B. | 次氯酸分子的结构式:H-O-Cl | |
| C. | 硫离子的电子排布式为:1s22s22p63s23p6 | |
| D. | 二氧化硅的分子式:SiO2 |
1.20℃、101kPa时,20L的下列气体中质量最大的是( )
| A. | N2 | B. | O2 | C. | CO2 | D. | CH4 |
 如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液
如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液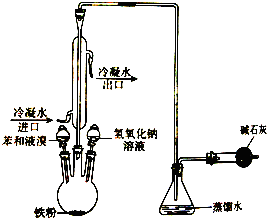 如图是实验室制取溴苯的装置图,请回答下列问题:
如图是实验室制取溴苯的装置图,请回答下列问题: