题目内容
8.三种常见元素结构信息如下表,试根据信息回答有关问题:| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键N-H…N-N-H…O-O-H…N-O-H…O-;A的氢化物分子结合一个H+形成阳离子后,其键角变大(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,
(4)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图
可简单表示如图1:
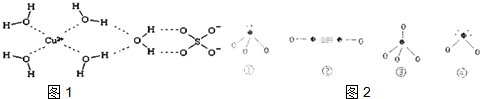
则胆矾晶体中含有ABCE
A.配位键 B.离子键 C.极性共价键 D.金属键 E.氢键F.非极性共价键
(5)下列分子结构图2中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.在以上分子中,中心原子采用sp3杂化形成化学键是①③④(填写序号).
分析 A的基态原子核外有两个电子层,最外层有3个未成对的电子,得到A的基态电子排布式1s22s22p3,为N元素;B基态原子的M层有1对成对的p电子,即有两个未成对的电子得到B原子的基态电子排布式为:1s22s22p63s23p4,为S元素;C态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价,说明最外层有1或2个电子,如为2,则为Zn,但化合价只有+2价,则应为[Ar]3d104s1,即Cu元素,
(1)B基态原子的M层有1对成对的p电子,即有两个未成对的电子,则电子数为16;
(2)在氨水中,由于N和O的非金属性较强,可形成氢键;N的氢化物分子结合一个H+形成阳离子后,为正四面体结构,键角变大;
(3)硫酸铜溶液中逐滴加入过量氨水溶液,生成的配合物为[Cu(NH3)4]SO4;
(4)根据胆矾晶体的结构图可知,在晶体中水分子与铜离子之间是配位键,氢氧之间是极性共价键,硫酸根和铜离子之间为离子键,水分子与水分子之间有氢键;
(5)①为氨气②为乙炔③为甲烷,④为水.
解答 解:A的基态原子核外有两个电子层,最外层有3个未成对的电子,得到A的基态电子排布式1s22s22p3,为N元素;B基态原子的M层有1对成对的p电子,即有两个未成对的电子得到B原子的基态电子排布式为:1s22s22p63s23p4,为S元素;C态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价,说明最外层有1或2个电子,如为2,则为Zn,但化合价只有+2价,则应为[Ar]3d104s1,即Cu元素,
(1)B基态原子的M层有1对成对的p电子,即有两个未成对的电子得到B原子的基态电子排布式为:1s22s22p63s23p4,
故答案为:1s22s22p63s23p4;
(2)在氨水中,由于N和O的非金属性较强,可形成氢键,溶液中存在的氢键有:N-H…N-或N-H…O-或 O-H…N-或O-H…O-等,N的氢化物分子结合一个H+形成阳离子后,为正四面体结构,键角变大,
故答案为:N-H…N-或N-H…O-或 O-H…N-或O-H…O-;变大;
(3)硫酸铜溶液中逐滴加入过量氨水溶液,生成的配合物为[Cu(NH3)4]SO4;
故答案为:[Cu(NH3)4]SO4;
(4)根据胆矾晶体的结构图可知,在晶体中水分子与铜离子之间是配位键,氢氧之间是极性共价键,硫酸根和铜离子之间为离子键,水分子与水分子之间有氢键,
故答案为:ABCE;
(5)①为氨气②为乙炔③为甲烷,④为水,其中氨气、甲烷和水的中心原子均以sp3杂化形成化学键;
故答案为:①③④.
点评 本题综合考查物质结构与性质知识,题目涉及电子排布式、氢键、配位键以及杂化类型等知识,难度中等,注意氢键的形成特点和配位键的形成.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | NaCl→HCl | B. | NaCl→Cl2 | C. | NaClO3→Cl2 | D. | Cl2→HCl |
| A. | 碳-12的原子符号:12 6C | |
| B. | 次氯酸分子的结构式:H-O-Cl | |
| C. | 硫离子的电子排布式为:1s22s22p63s23p6 | |
| D. | 二氧化硅的分子式:SiO2 |
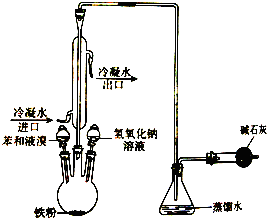 如图是实验室制取溴苯的装置图,请回答下列问题:
如图是实验室制取溴苯的装置图,请回答下列问题:
 ,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: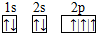 .
.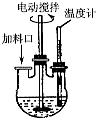 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.