题目内容
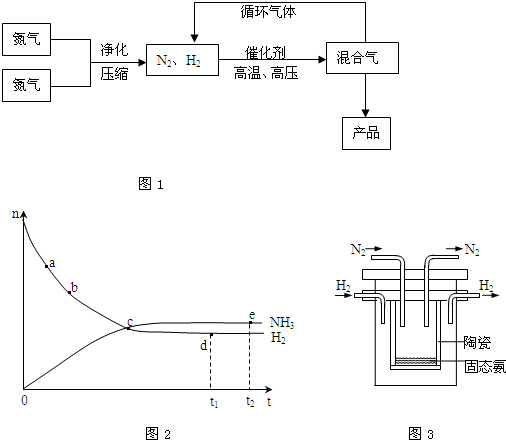
氨是最重要的氮肥,是产量最大的化工产品之一.课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)?2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖.工业上合成氨的部分工艺流程如图1:
反应体系中各组分的部分性质见下表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程.即反应后通过把混合气体的温度降低到 使混合气体分离出来产品;继续循环的气体是 .写出该反应的化学平衡常数表达式:K= .
(2)运用化学反应速率和化学平衡的观点说明工业上采取用上述实际生产措施的理由: .
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .
(4)合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图2所示.下列叙述正确的是
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d(t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图2中d点的值大
(5)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图3.阴极的电极反应式 .

反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
(2)运用化学反应速率和化学平衡的观点说明工业上采取用上述实际生产措施的理由:
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(4)合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图2所示.下列叙述正确的是
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d(t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图2中d点的值大
(5)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图3.阴极的电极反应式
考点:工业合成氨,常见化学电源的种类及其工作原理,化学平衡的调控作用,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据氨气易液化来解答;
(2)根据浓度对化学平衡的影响以及对原料利用率的影响来分析;
(3)依据化学方程式结合反应热=反应物的总键能-生成物的总键能计算反应热,标注物质聚集状态写出热化学方程式;
(4)在N2(g)+3H2(g)?2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断;
(5)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气.
(2)根据浓度对化学平衡的影响以及对原料利用率的影响来分析;
(3)依据化学方程式结合反应热=反应物的总键能-生成物的总键能计算反应热,标注物质聚集状态写出热化学方程式;
(4)在N2(g)+3H2(g)?2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断;
(5)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气.
解答:
解:(1)氨气的沸点是-33.42,可以将温度降低到-33.42,氨气液化,转变成液体分离出来,氢气和氮气可以再循环利用,平衡常数表达式为:
,故答案为:-33.42;N2、H2;
;
(2)生成物的浓度减少,平衡正向移动,所以及时分离出氨气,平衡正向移动,提高氨气的产率;循环利用氮气和氢气,提高氮气和氢气的转化率,
故答案为:及时分离出氨气,平衡正向移动,提高氨气的产率,且循环利用氮气和氢气,提高氮气和氢气的转化率;
(3)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,化学方程式为N2+3H2?2NH3,依据化学方程式计算反应热为946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92KJ/mol,反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92 kJ?mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ?mol-1;
(4)A、随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A正确;
B、c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;
C、d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;
D、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;
故答案为:AD;
(5)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
(2)生成物的浓度减少,平衡正向移动,所以及时分离出氨气,平衡正向移动,提高氨气的产率;循环利用氮气和氢气,提高氮气和氢气的转化率,
故答案为:及时分离出氨气,平衡正向移动,提高氨气的产率,且循环利用氮气和氢气,提高氮气和氢气的转化率;
(3)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,化学方程式为N2+3H2?2NH3,依据化学方程式计算反应热为946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92KJ/mol,反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92 kJ?mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ?mol-1;
(4)A、随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A正确;
B、c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;
C、d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;
D、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;
故答案为:AD;
(5)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3
点评:本题主要考查了浓度对化学平衡的影响、热化学方程式的书写以及化学平衡图象问题,题目难度不大,分析图象中时各物理量的变化曲线,把握平衡状态的特征为解答该题的关键.

练习册系列答案
相关题目
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2③3s23p3 ④3s23p4 第一电离能最大的是③ |
| C、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D、某元素气态基态原子的逐级电离能(kJ?mol-1)分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+ |
下列说法正确的是( )
| A、在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B、由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C、基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D、所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |