题目内容
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是KOH溶液.肼-空气燃料电
池放电时:正极的电极反应式是
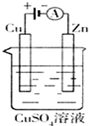
(3)如图是一个电化学过程示意图.假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气
考点:电解原理,热化学方程式,原电池和电解池的工作原理
专题:
分析:(1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应;
(3)根据转移电子相等计算需要空气的体积.
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应;
(3)根据转移电子相等计算需要空气的体积.
解答:
解:(1))32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,正极上是氧气发生得电子的还原反应,在碱性环境下,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑;
(3)若X、Y分别为石墨和铜,a为CuSO4溶液,电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=
,
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=
=112L,
故答案为:112.
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,正极上是氧气发生得电子的还原反应,在碱性环境下,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑;
(3)若X、Y分别为石墨和铜,a为CuSO4溶液,电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=
| 128g |
| 64g/mol |
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=
| ||
| 20% |
故答案为:112.
点评:本题考查了盖斯定律、原电池和电解池原理,明确原电池和电解池中放电顺序及串联电路中转移电子数相等即可解答,难度中等.

练习册系列答案
相关题目
下列有关实验的做法不正确的是( )
| A、分液时,分液漏斗的上层液体应由上口倒出 |
| B、用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| C、配置0.1000 mol?L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 |
| D、蒸馏操作时,冷凝管中的水应该上进下出 |
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉.对加入铁粉充分反应后的溶液分析合理的是( )
| A、若无固体剩余,则溶液中一定有Fe3+ |
| B、若溶液中有Cu2+,则一定没有固体析出 |
| C、若有固体存在,则溶液中一定有Fe2+ |
| D、若溶液中有Fe2+,则一定有Cu析出 |
一定条件下,在体积为1L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )
| A、X的百分含量不再发生变化 |
| B、c(X):c(Y):c(Z)=2:1:1 |
| C、容器内气体的质量不再发生变化 |
| D、同一时间内消耗2n mol X的同时生成n mol Z |
下列各说法正确的是( )
| A、弱电解质的导电能力一定比强电解质的导电能力弱 |
| B、pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液显碱性 |
| C、豆浆中加入硫酸钙会使蛋白质聚沉. |
| D、同浓度①NaHCO3、②Na2CO3、③CH3COONa三种溶液,pH大小顺序是②>③>① |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
将1L 0.1mol?L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L 0.5mol?L-1HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;将500mL 1mol?L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出的热量为( )
| A、(5a-2b) kJ |
| B、(2b-5a) kJ |
| C、(5a+2b) kJ |
| D、(10a+4b) kJ |