题目内容
将5.6g的铁粉加入200mLCuSO4的溶液,充分反应得到 6g固体沉淀物.试计算
(1)反应后生成铜的质量;
(2)原CuSO4溶液的物质的量浓度.
(1)反应后生成铜的质量;
(2)原CuSO4溶液的物质的量浓度.
考点:化学方程式的有关计算
专题:
分析:根据金属活动顺序表,铁排在铜的前面,铁和硫酸铜发生置换反应,依据Fe+CuSO4=FeSO4+Cu,计算反应后生成铜的质量,依据C=
求解原CuSO4溶液的物质的量浓度.
| n |
| v |
解答:
解:5.6g的铁的物质的量为n=
=
=0.1mol,Fe+CuSO4=FeSO4+Cu,若铁全部参加反应生成铜为0.1mol,为m=nM=0.1mol×64g/mol=6.4克,而实际充分反应得到6g固体沉淀物,所以设原CuSO4溶液中CuSO4的物质的量为xmol
Fe+CuSO4=FeSO4+Cu,
xmol xmol xmol xmol
则5.6g-56x+64x=6g,解得x=0.05mol,反应后生成铜的质量为m=nM=0.05mol×64g/mol=3.2g,原CuSO4溶液的物质的量浓度C=
=
=0.25mol/L,
答:(1)反应后生成铜的质量为3.2g;
(2)原CuSO4溶液的物质的量浓度为0.25mol/L;
| m |
| M |
| 5.6g |
| 56g/mol |
Fe+CuSO4=FeSO4+Cu,
xmol xmol xmol xmol
则5.6g-56x+64x=6g,解得x=0.05mol,反应后生成铜的质量为m=nM=0.05mol×64g/mol=3.2g,原CuSO4溶液的物质的量浓度C=
| n |
| v |
| 0.05mol |
| 0.2L |
答:(1)反应后生成铜的质量为3.2g;
(2)原CuSO4溶液的物质的量浓度为0.25mol/L;
点评:本题考查了化学方程式的计算,熟练掌握金属活动顺序表的应用以及有关物质的量的公式运用是解答关键,题目难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
不能发生丁达尔现象的分散系是( )
| A、豆浆 | B、氢氧化铁胶体 |
| C、水 | D、蔗糖水 |
下列描述中隐含化学变化的是( )
| A、水结成冰 |
| B、食盐溶于水 |
| C、燃放鞭炮 |
| D、将块状石灰石研磨成粉末 |
CO2通入下列各溶液中,不可能产生沉淀的是( )
| A、CaCl2溶液 |
| B、石灰水 |
| C、Ca(ClO)2溶液 |
| D、Na2SiO3溶液 |
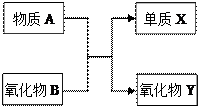 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:
