题目内容
现有 NH3、CO、Na、Na202、Fe、NO、NO2,F2、SO2.SOCl2 等中学化学教材中出现过的物质,根据它们的组成及性质进行如下分类
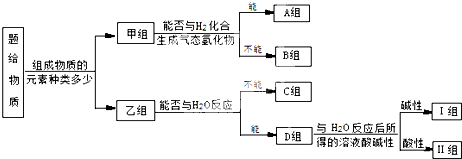
请回答下列问题
(1)图中所示的分类方法叫 .
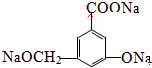
(2)淡黄色固体最终位于 组,它的电子式为 .
(3)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式 .
(4)Ⅱ组的某种物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为 .
(5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有 g该物质参与反应.
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,常用于某些盐的脱水以制取无水盐,写出该物质与AlCl3?6H20反应的化学方程式为 .

请回答下列问题
(1)图中所示的分类方法叫
(2)淡黄色固体最终位于
(3)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式
(4)Ⅱ组的某种物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为
(5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,常用于某些盐的脱水以制取无水盐,写出该物质与AlCl3?6H20反应的化学方程式为
考点:常见气体的检验,酸、碱、盐、氧化物的概念及其相互联系
专题:物质检验鉴别题
分析:NH3、CO、Na、Na202、Fe、NO、NO2,F2、SO2.SOCl2 等,按照组成元素的多少分为单质和化合物,属于单质的是Na、Fe、F2,属于化合物的是NH3、CO、Na202、NO、NO2、SO2、SOCl2;单质中能与氢气反应的是F2;化合物中能与水反应的是NH3、Na202、NO2、SO2、SOCl2,反应显碱性的是NH3、Na202;
(1)交叉法就是按照不同的标准进行分类,把物质分成若干类的方法;树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,据此分析解答;
(2)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气;
(3)C组有一种气体常用作工业上冶炼铁的还原剂是CO;
(4))Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,根据化合价的变化分析;
(5)B组中与水在高温条件下反应的物质为Fe,根据反应方程式分析;
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,该物质为SOCl2,SOCl2与水反应生成HCl和二氧化硫.
(1)交叉法就是按照不同的标准进行分类,把物质分成若干类的方法;树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,据此分析解答;
(2)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气;
(3)C组有一种气体常用作工业上冶炼铁的还原剂是CO;
(4))Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,根据化合价的变化分析;
(5)B组中与水在高温条件下反应的物质为Fe,根据反应方程式分析;
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,该物质为SOCl2,SOCl2与水反应生成HCl和二氧化硫.
解答:
解:(1)图示方法将多种单质和化合物按照层次,一层一层来分,符合树状分类的特点,属于树状分类,
故答案为:树状分类法;
(2)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气,最终位于I组;Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为 ,
,
故答案为:I; ;
;
(3)C组有一种气体常用作工业上冶炼铁的还原剂是CO,CO与Fe2O3在高温条件下生成Fe和二氧化碳,反应方程式为:Fe2O3+3CO
2Fe+3CO2;
故答案为:Fe2O3+3CO
2Fe+3CO2;
(4))Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,
所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,所以被氧化的NO2与被还原的NO2的物质的量之比为2:1;
故答案为:2:1;
(5)B组中与水在高温条件下反应的物质为Fe,反应的方程式为4H2O(g)+3Fe
Fe3O4+4H2,若该反应过程中有8×6.02×1023个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g/mol=168g;
故答案为:168;
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,该物质为SOCl2,SOCl2与水反应生成HCl和二氧化硫,则SOCl2与AlCl3?6H2O与SOCl2混合生成AlCl3、HCl、SO2,反应方程式为AlCl3?6H2O+6SOCl2=AlCl3+12HCl↑+6SO2↑,
故答案为:AlCl3?6H2O+6SOCl2=AlCl3+12HCl↑+6SO2↑.
故答案为:树状分类法;
(2)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气,最终位于I组;Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为
 ,
,故答案为:I;
 ;
;(3)C组有一种气体常用作工业上冶炼铁的还原剂是CO,CO与Fe2O3在高温条件下生成Fe和二氧化碳,反应方程式为:Fe2O3+3CO
| ||
故答案为:Fe2O3+3CO
| ||
(4))Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,
所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,所以被氧化的NO2与被还原的NO2的物质的量之比为2:1;
故答案为:2:1;
(5)B组中与水在高温条件下反应的物质为Fe,反应的方程式为4H2O(g)+3Fe
| ||
故答案为:168;
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,该物质为SOCl2,SOCl2与水反应生成HCl和二氧化硫,则SOCl2与AlCl3?6H2O与SOCl2混合生成AlCl3、HCl、SO2,反应方程式为AlCl3?6H2O+6SOCl2=AlCl3+12HCl↑+6SO2↑,
故答案为:AlCl3?6H2O+6SOCl2=AlCl3+12HCl↑+6SO2↑.
点评:本题综合考查氧化还原反应知识以及物质的分类,侧重于学生的分析能力和物质的性质的综合考查,注意把握题给信息结合元素化合价的角度分析,题目难度中等.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案
相关题目
四种基本化学反应类型①分解反应②化合反应③置换反应④复分解反应,其中不一定属于氧化还原反应的是( )
| A、③ | B、①② |
| C、①②③ | D、①②③④ |
用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是( )
| A、滴定前滴定管中有气泡,滴定后消失 |
| B、碱式滴定管量取NaOH溶液时,未进行润洗操作 |
| C、滴定时达到滴定终点时俯视读数 |
| D、锥形瓶取用NaOH待测液前加少量水洗涤 |


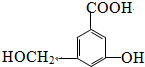
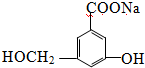
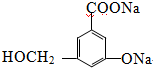
 .
.