题目内容
甲、乙两烧杯中各盛有200mL的相同浓度的盐酸和氢氧化钠溶液,向两烧杯中分别各加入5.4g的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则盐酸的物质的量浓度为( )
| A、1mol/L |
| B、1.5mol/L |
| C、2mol/L |
| D、2.5mol/L |
考点:化学方程式的有关计算,铝的化学性质
专题:计算题
分析:发生反应2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,铝粉质量一定,盐酸和氢氧化钠溶液中溶质的物质的量相同,若酸、碱足量,生成气体相同;铝粉都过量,酸、碱不足,生成气体为1:3,而实际应结束后测得生成的气体体积比为甲:乙=1:2,说明Al与盐酸反应时,盐酸不足,Al与碱反应时碱过量,结合方程式计算解答.
解答:
解:发生反应2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,铝粉质量一定,盐酸和氢氧化钠溶液中溶质的物质的量相同,若酸、碱足量,生成气体相同;铝粉都过量,酸、碱不足,生成气体为1:3,而实际应结束后测得生成的气体体积比为甲:乙=1:2,说明Al与盐酸反应时,盐酸不足,Al与碱反应时碱过量,
设5.4Al与氢氧化钠完全反应生成氢气物质的量为xmol,则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3mol
5.4g xmol
54g:5.4g=3mol:xmol
解得x=0.3,
则Al与盐酸反应生成氢气的物质的量=
=0.15mol,
设铝与盐酸反应时HCl的物质的量为y mol,则:
2Al+6HCl═2AlCl3+3H2↑
6 3
ymol 0.15mol
6:3=ymol:0.15mol,解得x=0.3,
则盐酸的物质的量浓度为
=1.5mol/L,
故选B.
设5.4Al与氢氧化钠完全反应生成氢气物质的量为xmol,则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3mol
5.4g xmol
54g:5.4g=3mol:xmol
解得x=0.3,
则Al与盐酸反应生成氢气的物质的量=
| 0.3mol |
| 2 |
设铝与盐酸反应时HCl的物质的量为y mol,则:
2Al+6HCl═2AlCl3+3H2↑
6 3
ymol 0.15mol
6:3=ymol:0.15mol,解得x=0.3,
则盐酸的物质的量浓度为
| 0.3mol |
| 0.2L |
故选B.
点评:本题考查化学反应方程式的计算,关键是判断Al与酸、碱反应过量情况,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用下列实验装置进行相应的实验,不能达到实验目的是( )


| A、图Ⅰ所示装置用于实验室制取氨气 |
| B、图Ⅱ所示装置用于制备少量氢气 |
| C、图Ⅲ所示装置用于测定中和反应的反应热. |
| D、图IV所示装置用于证明非金属性强弱S>C>Si |
“脚印”、“笑脸”、“五环”等焰火让北京奥运会开幕式更加辉煌壮观,这些五彩缤纷的焰火与元素的焰色反应有关.下列说法错误的是( )
| A、焰色反应一定发生化学变化 |
| B、Na与NaCl在灼烧时火焰颜色相同 |
| C、焰色反应是物质检验的一种实验方法 |
| D、观察K2SO4的焰色应透过蓝色的钴玻璃 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )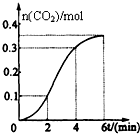

| A、反应开始2分钟内平均反应速率最大 |
| B、反应4分钟后平均反应速率最小 |
| C、反应开始4分钟内温度对反应速率的影响比浓度大 |
| D、反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D、含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
下列有关Na2CO3与NaHCO3的说法中正确的是( )
| A、热稳定性:Na2CO3<NaHCO3 |
| B、碱性:Na2CO3<NaHCO3 |
| C、水中的溶解度:Na2CO3<NaHCO3 |
| D、Na2CO3与NaHCO3可相互转化 |
W、X,Y,Z均为短周期元素,X,Y处于同一周期,X,Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A、原子最外层电子数:X>Y>Z |
| B、单质沸点:X>Y>Z |
| C、离子半径:X2->Y+>Z- |
| D、原子序数:X>Y>Z |
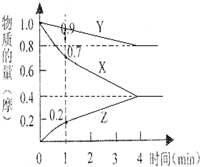 (1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
(1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为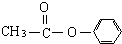 、
、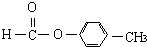 外还有四种,请分别写出结构简式:
外还有四种,请分别写出结构简式: