题目内容
11.下列仪器对应名称不正确的是( )| A. |  蒸馏烧瓶 | B. |  冷凝管 | C. |  蒸发皿 | D. |  分液漏斗 |
分析  为圆底烧瓶,其它仪器名称均正确,以此来解答.
为圆底烧瓶,其它仪器名称均正确,以此来解答.
解答 解:A. 为圆底烧瓶,蒸馏烧瓶具有支管,故A错误;
为圆底烧瓶,蒸馏烧瓶具有支管,故A错误;
B. 为冷凝管,用于冷凝,故B正确;
为冷凝管,用于冷凝,故B正确;
C. 为蒸发皿,用于溶液与可溶性固体的分离,故C正确;
为蒸发皿,用于溶液与可溶性固体的分离,故C正确;
D. 为分液漏斗,用于萃取、分液,分离分层的液体混合物,故D正确;
为分液漏斗,用于萃取、分液,分离分层的液体混合物,故D正确;
故选A.
点评 本题考查仪器的结构及名称,为高频考点,把握常见化学仪器的结构、使用为解答的关键,侧重分析与实验能力的考查,注意相似仪器的区别,题目难度不大.

练习册系列答案
相关题目
1.下列各物质中的少量杂质,可用括号内的试剂和方法除去的是( )
| A. | 苯中溶有苯酚(浓溴水,过滤) | B. | 溴苯中溶有溴(苯,分液) | ||
| C. | CO2中含有SO2(KMnO4酸性溶液,洗气) | D. | 乙醇中含有水(金属钠,蒸馏) |
2.下列关于有机化合物的说法正确的是 ( )
| A. | 分子式为C3H6Cl2的有机物有4种同分异构体 | |
| B. | 包装用材料聚乙烯分子中含有碳碳双键 | |
| C. | 乙炔和溴的四氯化碳溶液反应成1,2-二溴乙烷 | |
| D. | 油脂与NaOH浓溶液反应制高级脂肪酸钠属于加成反应 |
19.已知有如下反应:
①ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
②2FeCl3+2KI═2FeCl2+2KCl+I2,
③2FeCl2+Cl2═2FeCl3,下列说法正确的是( )
①ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
②2FeCl3+2KI═2FeCl2+2KCl+I2,
③2FeCl2+Cl2═2FeCl3,下列说法正确的是( )
| A. | 反应①中氧化剂与还原剂的物质的量之比为5:1 | |
| B. | 反应②中FeCl3只作氧化剂,反应③中FeCl3只是氧化产物 | |
| C. | 反应②中每生成127g I2,转移的电子数为2NA | |
| D. | 根据上述三个反应可知氧化性:ClO3->Cl2>Fe3+>I2 |
6.在密闭容器中,反应2NO2?N2O4在不同条件下的化学平衡情况如图a、图b所示.图a表示恒温条件下c(NO2)的变化情况;图b表示恒压条件下,平衡体系中N2O4的质量分数随温度的变化情况(实线上的任意一点为对应温度下的平衡状态).下列说法正确的是( )
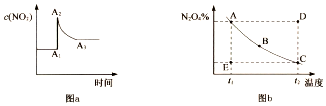

| A. | 其它条件不变时,向平衡体系中充入N2O4,平衡常数增大 | |
| B. | 图a中,A1一A2变化的原因一定是充人了NO2 | |
| C. | 图b中,E点对应状态中,v(正)>v(逆) | |
| D. | 图b中,E→A所需时间为x,D→C所需时间为y,则x<y |
16.医学上通过研究并实现了利用含放射性元素32P的“纸贴”治疗疤痕疙瘩,下列有关32P和31P的叙述正确的是( )
| A. | 32P和31P属于同一种核素 | B. | 32P的原子中所含的质子数为16 | ||
| C. | 31P的中子数为16 | D. | 32P的摩尔质量为32 |
3.下列离子方程式书写正确的是( )
| A. | 铁粉放入稀硫酸溶液:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 石灰石与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | Cl2通入水中:Cl2+H2O?H++Cl-+HClO |
3.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为HCO3-+H2O?H2CO3+OH-乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3.丙同学认为甲、乙的判断都不充分.丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于(填“高于”、“低于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和bmol/L,则a与b的具体关系是a=10-4b
(4)25℃时,浓度均为0.3mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是C
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大.
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于(填“高于”、“低于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和bmol/L,则a与b的具体关系是a=10-4b
(4)25℃时,浓度均为0.3mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是C
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大.
4.某溶液中只可能含有下列离子中的几种:Na+、NH4+、SO42-、CO32-、NO3-、Cl-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
(2)第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
(3)在(2)的滤液中滴入AgNO3,产生白色沉淀,加稀硝酸,沉淀不溶解.
下列说法正确的是( )
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
(2)第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
(3)在(2)的滤液中滴入AgNO3,产生白色沉淀,加稀硝酸,沉淀不溶解.
下列说法正确的是( )
| A. | 该溶液中可能含Na+ | B. | 该溶液中肯定含有NH4+、SO42-、Cl- | ||
| C. | 该溶液中一定不含NO3-、CO3- | D. | 该溶液中一定含有Na+ |