题目内容
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于
(2)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a、6CO2+6H2O
| 光合作用 |
b、CO2+3H2
| 催化剂 |
| △ |
c、CO2+CH4
| 催化剂 |
| △ |
d、2CO2+6H2
| 催化剂 |
| △ |
以上反应中,原子利用率最高的是
(3)若有4.4kg CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9kJ的热量,试写出该反应的热化学方程式
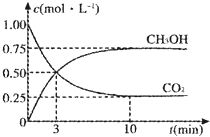
(4)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器,充入1mol CO2和3molH2,进行反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.从反应开始到平衡v(H2)=
(5)CO2在自然界循环时可与CaCO3反应.CaCO3是一种难溶物质,其Ksp═2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将4×10-4mol/L Na2CO3溶液与某浓度的CaCl2溶液等体积混合,则生成沉淀所需CaCl2溶液的最小浓度为
考点:常见的生活环境的污染及治理,热化学方程式,化学平衡常数的含义,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:(1)根据氟利昂能产生氯原子,而氯原子是臭氧分解的催化剂;
(2)不需要加热则最节能,原子利用率最高的是把所有的反应物全部转化为产物;
(3)根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量.书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位;
(4)根据v=△
计算;根据CO2的平衡浓度判断转化的物质的量,进而可计算转化率;根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;根据平衡移动分析;
(5)Na2CO3溶液的浓度为4×10-4mol/L,等体积混合后溶液中c(CO32-)=2×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
(2)不需要加热则最节能,原子利用率最高的是把所有的反应物全部转化为产物;
(3)根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量.书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位;
(4)根据v=△
| △c |
| △t |
(5)Na2CO3溶液的浓度为4×10-4mol/L,等体积混合后溶液中c(CO32-)=2×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答:
解:(1)氟利昂在空气中能产生氯原子,而氯原子是臭氧分解的催化剂,CO2作致冷剂可防止臭氧层破坏,故答案为:保护臭氧层;
(2)不需要加热则最节能,a反应中利用太阳能,不需加热最节能,原子利用率最高的是把所有的反应物全部转化为产物,c反应中只有一种产物,原子利用率最高,
故答案为:c;
(3)根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol,故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol;
(4)利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
=0.225 mol?L-1?min-1,
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k═
=
=5.3,
故答案为:0.225 mol?L-1?min-1;5.3;
(5)等体积的CaCl2溶液与Na2CO3溶液混合时,碳酸钠溶液的浓度变为2×10-4mol/L,根据溶度积常数计算,c(Ca2+)=
=
=1.4×10-5mol/L,因为是等体积混合,所以混合前溶液的浓度是混合后的2倍,所以混合前溶液的浓度为1.4×10-5mol/L×2=2.8×10-5mol/L,故答案为:2.8×10-5mol/L.
(2)不需要加热则最节能,a反应中利用太阳能,不需加热最节能,原子利用率最高的是把所有的反应物全部转化为产物,c反应中只有一种产物,原子利用率最高,
故答案为:c;
(3)根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol,故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol;
(4)利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2.25mol/L |
| 10min |
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k═
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |
故答案为:0.225 mol?L-1?min-1;5.3;
(5)等体积的CaCl2溶液与Na2CO3溶液混合时,碳酸钠溶液的浓度变为2×10-4mol/L,根据溶度积常数计算,c(Ca2+)=
| Ksp(CaCO3) | ||
c(C
|
| 2.8×10-9 |
| 2×10-4 |
点评:本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、化学反应热效应数值与参加反应的物质多少有关 |
| B、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 |
| C、需要加热才能进行的化学反应不一定是吸热反应 |
| D、放热反应不需加热即可发生 |
在一定温度,可逆反应N2(g)+3H2(g)?2NH3(g)的平衡常数K=4,由此可以推测在该温度下,可逆反应2NH3(g)?N2(g)+3H2(g)的平衡常数是( )
| A、0.25 | B、2 | C、4 | D、16 |
实验室有一瓶久置的K2SO3粉末,为确定其是否变质进行的下述实验结论正确的是( )
| A、进行元素分析,测得粉末中K和S两种元素的质量比为39:16,则该粉末没有变质 |
| B、将粉末溶于水,加入氯化钡,有白色沉淀生成,则该粉末变质了 |
| C、将粉末加入盐酸中,产生气泡,则该粉末没有变质 |
| D、将粉末溶于水,滴加过量的盐酸,有气泡产生,再加入氯化钡溶液,有白色沉淀生成,则该粉末部分变质 |