题目内容
12.下列分子中的中心原子杂化轨道的类型相同的是( )| A. | CO2与H2O | B. | BeCl2与BF3 | C. | CH4与NH3 | D. | C2H2与C2H4 |
分析 ABm型杂化类型的判断:
公式:电子对数n=$\frac{1}{2}$(中心原子的价电子数+配位原子的成键电子数±电荷数)
注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”.
②当配位原子为氧原子或硫原子时,成键电子数为零.
对于有机物利用杂化轨道数n=孤对电子对数+σ键数.
根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化.
解答 解:A.CO2中C原子杂化轨道数为$\frac{1}{2}$×(4+0)=2,采取sp杂化方式,H2O中O原子杂化轨道数为$\frac{1}{2}$×(6+2)=4,采取sp3杂化方式,两者中心原子杂化轨道的类型不同,故A错误;
B.BeCl2中Be原子杂化轨道数为$\frac{1}{2}$(2+2)=2,采取 sp杂化方式,BF3中B原子杂化轨道数为$\frac{1}{2}$(3+3)=3,采取 sp2杂化方式,两者中心原子杂化轨道的类型不同,故B错误;
C.CH4中C原子杂化轨道数为$\frac{1}{2}$×(4+4)=4,采取sp3杂化方式,NH3中N原子杂化轨道数为$\frac{1}{2}$(5+3)=4,采取 sp3杂化方式,两者中心原子杂化轨道的类型相同,故C正确;
D.C2H2分子中碳原子形成1个C-H,1个C≡C三键,C原子杂化轨道数为(1+1)=2,采取 sp杂化方式,C2H4分子中碳原子形成2个C-H,1个C═C双键,C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式,两者中心原子杂化轨道的类型不同,故D错误;
故选C.
点评 本题考查杂化轨道理论,题目难度中等,判断中心原子的杂化轨道数是关键.

练习册系列答案
相关题目
14.能源分类相关图如图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
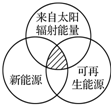

| A. | 沼气、煤炭、石油 | B. | 海洋能、地热能、核能 | ||
| C. | 天然气、水能、生物能 | D. | 风能、太阳能、潮汐能 |
20.①花生油和水混合液②39%的乙醇溶液③使浑浊的食盐水变澄清,分离上各混合物的正确方法依次是( )
| A. | 分液、过滤、蒸馏 | B. | 过滤、蒸馏、分液 | C. | 分液、蒸馏、过滤 | D. | 蒸馏、过滤、分液 |
17.高铁酸盐在能源、环保等方面有着广泛的用途.工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示,则下列说法不正确的是( )
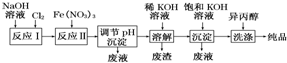

| A. | 反应Ⅰ主要为2NaOH+Cl2═NaCl+NaClO+H2O 反应Ⅱ的离子方程式为3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O | |
| B. | 加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出 | |
| C. | 调节pH析出的沉淀为高铁酸钠,用异丙醇洗涤的主要目的是有利于产品干燥 | |
| D. | 高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3有吸附性,有絮凝作用 |
4.下列各微粒的电子式书写正确的是( )
| A. | 甲基  | B. | NF3  | C. | NH4H  | D. | 硫化氢  |
2.作为新世纪的年轻公民都应具有一定的化学科学素养,否则,在工作和生活中就可能闹笑话.下列有关媒体的报道与化学知识不相违背的是( )
| A. | 某饮料公司的广告语为“本公司生产的饮料不含任何化学物质” | |
| B. | 该科研人员发明了一种特殊催化剂,可以使水变为汽油 | |
| C. | 有关部门利用明矾对饮用水进行消毒杀菌,从而解决了灾民饮水难的问题 | |
| D. | 该科研机构发明了一种用植物秸秆生产乙醇的新工艺 |
 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中