题目内容
3.除杂质:所选试剂都填化学式(1)除去混入NaCl溶液中少量NaHCO3杂质的试剂是盐酸,离子方程式为HCO3-+H+=CO2↑+H2O.
(2)除去FeCl2溶液中混入的FeCl3溶液杂质用试剂是Fe粉,离子方程式为2Fe3++Fe=3Fe2+.
(3)除去Mg粉中混有的少量Al杂质的试剂是NaOH溶液,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
(4)除去NaHCO3溶液中混有的少量Na2CO3杂质的试剂是CO2,离子方程式为CO32-+CO2+H2O=2HCO3-.
分析 (1)除去混入NaCl溶液中少量NaHCO3杂质的试剂是HCl,碳酸氢钠和HCl反应生成氯化钠;
(2)FeCl3和Fe反应可生成FeCl2;
(3)Al与NaOH溶液反应,而Mg不能;
(4)可通入过量二氧化碳除去Na2CO3.
解答 解:(1)除去混入NaCl溶液中少量NaHCO3杂质的试剂是盐酸,碳酸氢钠和HCl反应生成氯化钠,离子方程式为HCO3-+H+=CO2↑+H2O,
故答案为:盐酸;HCO3-+H+=CO2↑+H2O;
(2)Fe能与氯化铁反应生成氯化亚铁,则选择除杂试剂为Fe粉,发生的离子反应为2Fe3++Fe=3Fe2+,故答案为:Fe粉;2Fe3++Fe=3Fe2+;
(3)Al可与NaOH反应,而Mg不能,反应后过滤可除杂,反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:NaOH溶液;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(4)可通入过量二氧化碳除去Na2CO3,方程式为Na2CO3+CO2+H2O=2NaHCO3,离子反应为CO32-+CO2+H2O=2HCO3-,故答案为:CO2;CO32-+CO2+H2O=2HCO3-.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
6.下列各组中,可以用相同的方法除去混有的杂质的是( )
| A. | 淀粉溶液中混有少量NaCl与蔗糖中混有少量NaCl | |
| B. | Fe(OH)3胶体中混有少量盐酸与淀粉溶液中混有少量KI溶液 | |
| C. | Na2CO3中混有少量NaHCO3与NaHCO3中混有少量Na2CO3 | |
| D. | CO2中混有少量SO2与CO2中混有少量HCl气体 |
3.下列关于二氧化硅的说法中正确的是( )
| A. | 二氧化硅溶于水所得溶液能使紫色石蕊溶液变为红色 | |
| B. | 二氧化硅是非金属化物,易溶于水 | |
| C. | 二氧化硅与石棉(CaO•3MgO•4SiO2)都是硅盐酸 | |
| D. | 二氧化硅与硅酸都能溶于烧碱 |
10.下列反应属于取代反应的是( )
| A. | CH4$\stackrel{高温}{→}$C+2H2 | B. | 2HI+Cl2═2HCl+I2 | ||
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | D. | CH2Cl+Cl2$\stackrel{光}{→}$CH2Cl2+HCl |
12.下列分子中的中心原子杂化轨道的类型相同的是( )
| A. | CO2与H2O | B. | BeCl2与BF3 | C. | CH4与NH3 | D. | C2H2与C2H4 |
13.某国一集团拟在太空建造巨大的激光装置,把太阳光变成激光用于分解海水制氢:2H2O$\frac{\underline{\;激光\;}}{\;}$H2↑+O2↑,下列说法正确的是( )
| A. | 水的分解反应是放热反应 | |
| B. | 氢气是一级能源 | |
| C. | 大量使用氢气作燃料会造成温室效应 | |
| D. | 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可以改善生存环境 |
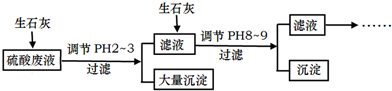
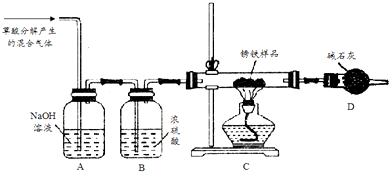
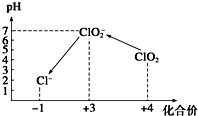 ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.