题目内容
12.下列事实不可以证明乙酸是弱酸的是( )| A. | 乙酸溶液的导电性比盐酸溶液的弱 | |
| B. | 0.1mol/L乙酸钠溶液的pH约为8 | |
| C. | 把0.1mol/L乙酸溶液温度升高10℃后(不考虑水蒸发),其 pH降低 | |
| D. | 等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应快 |
分析 A.导电性强弱和离子浓度大小有关,与电解质强弱无直接关系;
B.0.1mol/L乙酸钠溶液的pH约为8,溶液显碱性证明乙酸钠为强碱弱酸盐,溶液中乙酸根离子水解;
C.把0.1mol/L乙酸溶液温度升高10℃后,溶液PH降低,说明溶液中存在电离平衡,升温促进电离氢离子浓度增大;
D.等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应盐酸反应快,说明乙酸溶液中氢离子浓度小;
解答 解:A.导电性强弱和离子浓度大小有关,乙酸溶液的导电性比盐酸溶液的只能说明乙酸溶液中离子浓度小,但乙酸溶质浓度和氯化氢浓度不知,不能判断乙酸溶液中存在电离平衡,故A错误;
B.0.1mol/L乙酸钠溶液的pH约为8,溶液显碱性,溶液中乙酸根离子存在水解平衡,证明乙酸为弱酸电解质属于,故B正确;
C.升温促进电离,把0.1mol/L乙酸溶液温度升高10℃后,溶液PH降低,说明溶液中存在电离平衡,氢离子浓度增大溶液中存在电离平衡属于弱电解质,故C正确;
D.等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应盐酸反应快,说明开始乙酸溶液中氢离子浓度小存在电离平衡属于弱电解质,故D正确;
故选A.
点评 本题考查了弱酸的电离平衡及其应用,题目难度不大,注意掌握弱电解质的概念及判断方法,明确弱电解质的电离平衡及其影响因素,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
2.如表表格中各项分类都正确的一组是( )
类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 生理盐水 | 明矾 | 液态KNO3 | 蔗糖 |
| B | CaO | 海 水 | 铜 | 乙醇 |
| C | 胆矾 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
3.25℃时,在等体积的 ①pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2CO3溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A. | 1:10:104:109 | B. | 1:5:5×109:5×108 | C. | 1:20:1010:109 | D. | 1:10:1010:109 |
20.有7种物质:①甲烷;②苯;③聚乙烯;④聚异戊二烯;⑤2-丁炔;⑥环己烷;⑦环己烯.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ④⑤⑥⑦ | B. | ④⑤⑦ | C. | ②④⑤ | D. | ②④⑤⑦ |
17.2011年11月1日凌晨,“神舟八号”飞船成功发射升空,之后完成了与此前发射的“天宫一号”的成功交会对接,其中新材料铝锂合金为“太空之吻”提供了保障.下列对铝元素和锂元素的认识正确的是( )
| A. | 锂是碱金属元素,可以保存在煤油中 | |
| B. | 铝离子和锂离子的核外电子排布相同 | |
| C. | Li+的半径大于H-的半径 | |
| D. | 短周期中能与强碱反应产生H2的金属元素是铝,在周期表中位于第ⅢA族 |
6.25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )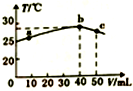

| A. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 | |
| B. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| C. | b→c的过程中,温度降低的主要原因是溶液中发生了吸热反应 | |
| D. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
7.92235U是重要的核工业原料,下列有关92235U说法正确的是( )
| A. | 92235U原子核中含有92个中子 | B. | 92235U子核外有143个电子 | ||
| C. | 92235U与92238U互为同位素 | D. | 92235U与92238U互为同素异形体 |
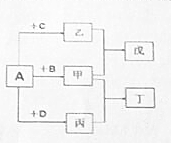 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.