题目内容
4.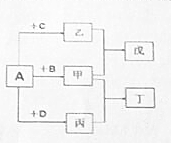 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.(1)将甲和丙两气体混合后产生白烟,则丁的电子式为
 ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.(2)写出一种由a、b、c、d四种元素组成的化合物的化学式NH4ClO,该化合物形成的晶体是离子晶体(填晶体类型).
(3)高温时,甲与C在催化剂作用下加热可以发生反应.该反应是工业生产某强酸的重要环节,若将12.8g铜与一定量的该浓酸反应,铜消耗完时,共产生气体4.48L(标准情况),则所消耗的酸的物质的量是0.6 mol,所得气体的平均摩尔质量为38g/mol.
(4)t℃时,将2mol A和2mol B通入体积为2L的恒温恒容密闭容器中,2min时反应达到化学平衡,此时测得反应物B还剩余1.6mol.请填写下列空白:
从反应开始至达到化学平衡,生成甲的平均反应速率为0.2mol/(L•min),平衡A的转化率为60%,容器中反应前后的压强比为5:4.
分析 将甲和丙两气体混合后产生白烟,判断为氨气和氯化氢气体反应生成的氯化铵,转化关系为A+B=甲,A+D=丙,则A为H2,甲、乙、丙分子内原子数依次为4、3、2,推断甲为NH3,丙为HCl,B为N2,D为Cl2,短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.则c元素的电子层为2个,形成乙为三原子分子,判断C为H2O,短周期元素a、b、c、d的原子序数依次增大分别为:H、N、O、Cl,戊为一水合氨溶液,
(1)将甲和丙两气体混合后产生白烟丁为氯化铵,是离子化合物,将甲通入乙中所得溶液为一水合氨溶液,一水合氨电离生成氢氧化根离子和铵根离子溶液显碱性溶液PH大于7;
(2)由a、b、c、d四种元素组成的化合物可以是离子化合物NH4ClO;
(3)铜和硝酸反应生成硝酸铜与NO2、NO的混合气体,反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量;
依据氧化剂与得到的电子数与还原剂失去的电子数相等计算二氧化氮和一氧化氮的物质的量进而求其摩尔质量;
(4)t℃时,将2mol A和2mol B通入体积为2L的恒温恒容密闭容器中,2min时反应达到化学平衡,此时测得反应物B还剩余1.6mol.反应B为2.0mol-1.6mol=0.4mol,结合化学三行计算列式计算,
3H2+N2=2NH3
起始量(mol) 2 2 0
变化量(mol) 1.2 0.4 0.8
平衡量(mol) 0.8 1.6 0.8
反应速率v=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%,气体压强之比等于气体物质的量之比;
解答 解:(1)将甲和丙两气体混合后产生白烟丁为氯化铵,氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,将甲通入乙中所得溶液为一水合氨溶液,一水合氨电离生成氢氧化根离子和铵根离子溶液显碱性溶液PH大于7,电离方程式为:NH3•H2O?NH4++OH-;
,将甲通入乙中所得溶液为一水合氨溶液,一水合氨电离生成氢氧化根离子和铵根离子溶液显碱性溶液PH大于7,电离方程式为:NH3•H2O?NH4++OH-;
故答案为: ;NH3•H2O?NH4++OH-;
;NH3•H2O?NH4++OH-;
(2)由a、b、c、d四种元素组成的化合物可以是离子化合物NH4ClO,形成晶体为离子晶体,
故答案为:NH4ClO;离子;
(3)n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,
根据氮原子守恒得消耗的n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.2mol=0.6mol;
设生成的二氧化氮的物质的量xmol,生成的一氧化氮的物质的量为ymol,
结合转移电子守恒列方程组为:
x+y=0.2
x+3y=0.2×2
解得,x=0.1,y=0.1
混合气体平均分子摩尔质量=$\frac{0.1mol(30+46)g/mol}{0.2mol}$=38g/mol,
故答案为:0.6 mol;38g/mol;
(4)t℃时,将2mol A和2mol B通入体积为2L的恒温恒容密闭容器中,2min时反应达到化学平衡,此时测得反应物B还剩余1.6mol.反应B为2.0mol-1.6mol=0.4mol,结合化学三行计算列式计算,
3H2+N2=2NH3
起始量(mol) 2 2 0
变化量(mol) 1.2 0.4 0.8
平衡量(mol) 0.8 1.6 0.8
生成甲的平均反应速率为v=$\frac{△c}{△t}$$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L•min),
平衡A转化率=$\frac{消耗量}{起始量}$×100%=$\frac{1.2mol}{2mol}$×100%=60%,
气体压强之比等于气体物质的量之比,容器中反应前后的压强比=(2+2):(0.8+1.6+0.8)=5:4,
故答案为:0.2mol/(L•min);60%;5:4.
点评 本题考查了原子结构、微粒性质及其单质化合物的转化关系分析判断、化学方程式计算、化学平衡计算等知识点,掌握基础是解题关键,题目难度中等.

| A. | KHCO3 | B. | AlCl3 | C. | Na2SO3 | D. | Fe2(SO4)3 |
| A. | 苯与浓溴水反应制溴苯 | |
| B. | 向苯酚稀溶液中加过量饱和溴水观察沉淀 | |
| C. | 将乙醛滴入银氨溶液中,直接加热煮沸制银镜 | |
| D. | 1mol•L-1的CuSO4溶液2mL和0.5mol•L-1的NaOH溶液4mL混合后,加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀颜色 |
| A. | 乙酸溶液的导电性比盐酸溶液的弱 | |
| B. | 0.1mol/L乙酸钠溶液的pH约为8 | |
| C. | 把0.1mol/L乙酸溶液温度升高10℃后(不考虑水蒸发),其 pH降低 | |
| D. | 等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应快 |
| 命名 | 一氯代物 | |
| A | 2-甲基-2-乙基丙烷 | 3 |
| B | 1,3-二甲基苯 | 3 |
| C | 2,2,3-三甲基戊烷 | 6 |
| D | 2,3-二甲基-4-乙基己烷 | 7 |
| A. | A | B. | B | C. | C | D. | D |
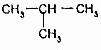 的关系是同系物
的关系是同系物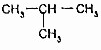 (异丁烷)的关系是同分异构体.
(异丁烷)的关系是同分异构体. .从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为N>O>B.
.从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为N>O>B.