题目内容
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H1=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H2=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-890kJ/mol
下列说法不正确是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H1=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H2=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-890kJ/mol
下列说法不正确是( )
分析:A、根据△G=△H-T△S判断,△G<0反应自发进行,△G>0反应不能自发进行;
B、与反应②比较,1molCH3OH(g)能量高于1molCH3OH(l),根据能量守恒定律判断;
C、在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol,结合反应③判断;
D、根据盖斯定律,由已知热化学方程式构造目标热化学方程式.
B、与反应②比较,1molCH3OH(g)能量高于1molCH3OH(l),根据能量守恒定律判断;
C、在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol,结合反应③判断;
D、根据盖斯定律,由已知热化学方程式构造目标热化学方程式.
解答:解:A、反应②的△H<0,△S<0,反应是否自发进行与温度有关,在低温下,焓变影响为主,高温时,熵变影响为中,温度的影响取决于△H、△S的具体数据,故A错误;
B、与反应②比较,1molCH3OH(g)能量高于1molCH3OH(l),反应物的总能量相同,根据能量守恒定律可知该反应放出的热量小于反应②,故△H>-90.5kJ/mol,故B正确;
C、由反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-890kJ/mol可知,1mol甲烷完全燃烧生成液态水放出的热量大于890kJ,故甲烷的燃烧热大于890kJ/mol,故C错误;
D、根据盖斯定律,③×2-①-②×2得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1528kJ/mol,故D正确.
故选AC.
B、与反应②比较,1molCH3OH(g)能量高于1molCH3OH(l),反应物的总能量相同,根据能量守恒定律可知该反应放出的热量小于反应②,故△H>-90.5kJ/mol,故B正确;
C、由反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-890kJ/mol可知,1mol甲烷完全燃烧生成液态水放出的热量大于890kJ,故甲烷的燃烧热大于890kJ/mol,故C错误;
D、根据盖斯定律,③×2-①-②×2得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1528kJ/mol,故D正确.
故选AC.
点评:本题考查反应热的计算、燃烧热概念、热化学方程式书写、反应方向的判断等,难度中等,注意表示燃烧热的热化学方程式,可燃物为1mol,一般H→H2O(l),C→CO2,S→SO2.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=-71kJ?mol-1
②CO(g)+2H2(g)=CH3OH(l);△H=-90.5kJ?mol-1
下列描述错误的是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=-71kJ?mol-1
②CO(g)+2H2(g)=CH3OH(l);△H=-90.5kJ?mol-1
下列描述错误的是( )
| A、CO(g)+2H2(g)═CH3OH(g)△H>-90.5kJ?mol-1 | ||
| B、在甲醇燃料电池中,甲醇所在电极为正极 | ||
C、CH4(g)+
| ||
D、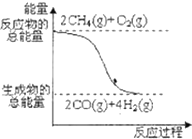 反应①中的能量变化如图所示 |
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,不能得出的结论是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,不能得出的结论是( )
| A、甲烷的燃烧热△H=-890kJ/mol | B、当4NA个碳氧共用电子对生成时,反应③放出890kJ的能量 | C、甲醇的燃烧热△H=-1528 kJ/mol | D、若CO的燃烧热△H=-282.5 kJ/mol,则H2的燃烧热△H=-286 kJ/mol |
|
甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知: ① 2CH4(g)+O2(g)② CO(g)+2H2(g)③ CH4(g)+2O2(g)下列说法不能得出的结论是 | |
| [ ] | |
A. |
在以上三个反应中,都是反应物的总能量大于生成物的总能量 |
B. |
CO(g)+2H2(g) |
C. |
甲醇的燃烧热为 764 kJ/mol |
D. |
若 CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |