题目内容
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,不能得出的结论是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,不能得出的结论是( )
| A、甲烷的燃烧热△H=-890kJ/mol | B、当4NA个碳氧共用电子对生成时,反应③放出890kJ的能量 | C、甲醇的燃烧热△H=-1528 kJ/mol | D、若CO的燃烧热△H=-282.5 kJ/mol,则H2的燃烧热△H=-286 kJ/mol |
分析:A.依据燃烧热的定义判断;
B.依据二氧化碳电子式知1mol二氧化碳含有共用电子对数为4NA,然后依据③解答;
C.依据燃烧热的概念解答;
D.一氧化碳燃烧的热化学方程式为CO(g)+
O2(g)=CO2(g)△=-△H=-282.5 kJ/mol,结合①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol、③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,利用盖斯定律求氢气燃烧的热化学方程式,据此解答.
B.依据二氧化碳电子式知1mol二氧化碳含有共用电子对数为4NA,然后依据③解答;
C.依据燃烧热的概念解答;
D.一氧化碳燃烧的热化学方程式为CO(g)+
| 1 |
| 2 |
解答:解:A.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,符合燃烧热的定义,故A正确;
B.当4NA个碳氧共用电子对生成时,也就是生成1mol二氧化碳,由热化学方程式③可知反应方程热量890kJ的能量,故B正确;
C.燃烧热是指在25摄氏度,101 kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,从给出的信息中求不出甲醇的燃烧热,故C错误;
D.①①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol,
②CO(g)+
O2(g)=CO2(g)△=-△H=-282.5 kJ/mol,
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
根据盖斯定律
得:H2(g)+
O2(g)=H2O(g)△H=-286 kJ/mol,所以氢气的燃烧热燃烧热△H=-286 kJ/mol,故D正确;
故选C.
B.当4NA个碳氧共用电子对生成时,也就是生成1mol二氧化碳,由热化学方程式③可知反应方程热量890kJ的能量,故B正确;
C.燃烧热是指在25摄氏度,101 kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,从给出的信息中求不出甲醇的燃烧热,故C错误;
D.①①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-71kJ/mol,
②CO(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
根据盖斯定律
| (③×2-①)-②×2 |
| 4 |
| 1 |
| 2 |
故选C.
点评:本题考查了燃烧热的定义和盖斯定律求反应热,理解燃烧热时注意生成的物质是稳定的氧化物.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=-71kJ?mol-1
②CO(g)+2H2(g)=CH3OH(l);△H=-90.5kJ?mol-1
下列描述错误的是( )
①2CH4(g)+O2(g)=2CO(g)+4H2(g);△H=-71kJ?mol-1
②CO(g)+2H2(g)=CH3OH(l);△H=-90.5kJ?mol-1
下列描述错误的是( )
| A、CO(g)+2H2(g)═CH3OH(g)△H>-90.5kJ?mol-1 | ||
| B、在甲醇燃料电池中,甲醇所在电极为正极 | ||
C、CH4(g)+
| ||
D、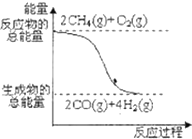 反应①中的能量变化如图所示 |
|
甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知: ① 2CH4(g)+O2(g)② CO(g)+2H2(g)③ CH4(g)+2O2(g)下列说法不能得出的结论是 | |
| [ ] | |
A. |
在以上三个反应中,都是反应物的总能量大于生成物的总能量 |
B. |
CO(g)+2H2(g) |
C. |
甲醇的燃烧热为 764 kJ/mol |
D. |
若 CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |