题目内容
4.240mL浓度为5mol/L的Na2SO3的溶液,恰好被200mL浓度为2mol/L的K2Cr2O7溶液完全反应,则元素铬在被还原的产物中的化合价是( )| A. | +6 | B. | +3 | C. | +4 | D. | +2 |
分析 Na2SO3被K2Cr2O7氧化,S元素的化合价由+4价升高为+6,Cr被还原后元素的化合价降低,结合电子守恒计算.
解答 解:Na2SO3被K2Cr2O7氧化,S元素的化合价由+4价升高为+6,
设Cr被还原后元素的化合价为x,
由电子守恒可知,
0.24L×5mol/L×(6-4)=0.2L×2mol/L×2×(6-x),
解得x=+3,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握元素的化合价变化、电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
14.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
| A. | 10℃20 mL 3 mol•L-1的盐酸溶液 | B. | 20℃30 mL 2 mol•L-1的盐酸溶液 | ||
| C. | 20℃20 mL 2 mol•L-1的盐酸溶液 | D. | 20℃10 mL 4 mol•L-1的盐酸溶液 |
12.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳. 该电池负极发生的反应是( )
| A. | CH3OH(g)+O2(g)═H2O(1)+CO2(g)+2H+(aq)+2e - | |
| B. | O2(g)+4H+(aq)+4e -═2H2C(1) | |
| C. | CH3OH(g)+H2O(1)═CO2(g)+6H+(aq)+6e - | |
| D. | O2(g)+2H2O(1)+4e -═4OH - |
19.下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃).
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式C6H5OH+PO43-=C6H5O-+HPO42-;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚(C6H5OH)溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是d;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1<T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是D.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式C6H5OH+PO43-=C6H5O-+HPO42-;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚(C6H5OH)溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是d;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1<T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是D.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点

13.下列说法不正确的是( )
| A. | 甲苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 用银氨溶液可以鉴别乙醛和麦芽糖溶液 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
14.下列属于放热反应的是( )
| A. | 浓硫酸稀释 | B. | 氢气还原氧化铜 | ||
| C. | 氢氧化钡与氯化铵固体混合搅拌 | D. | 铝和稀硫酸反应 |
 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为 ,B在周期表中的位置第三周期第VA族,C的离子结构示意图为
,B在周期表中的位置第三周期第VA族,C的离子结构示意图为 .
.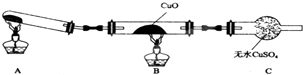 某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.
某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.