题目内容
6.实验是化学研究的基础,关于各实验装置图的叙述中,正确的是( )
| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和硝基苯的混合物 | |
| C. | 装置③可用于以苯为原料萃取碘水中的碘 | |
| D. | 装置④可用于实验室制取乙烯 |
分析 A.制取乙酸乙酯时用饱和碳酸钠溶液且导气管不能伸入液面下;
B.蒸馏时,温度计水银球位于蒸馏烧瓶支管口处;
C.碘易溶于苯;
D.缺少温度计.
解答 解:A.制取乙酸乙酯时用饱和碳酸钠溶液且导气管不能伸入液面下,否则会产生倒吸现象,故A错误;
B.蒸馏时,温度计水银球位于蒸馏烧瓶支管口处,不能插入液面下,故B错误;
C.碘易溶于苯,苯和水不溶,可做萃取剂,故C正确;
D.反应需加热到170℃,缺少温度计,故D错误.
故选C.
点评 本题考查了实验方案评价,涉及物质的制取、分离提纯等知识点,明确物质的性质是解本题关键,同时考查学生思考问题的缜密性,知道A中饱和碳酸钠溶液的作用,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:S2-、NO3-、Cl-、Na+ | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| D. | 由水电离出来的c(H+)=10-10mol•L-1的溶液:Na+、SO42-、S2-、HCO3- |
11.下列说法正确的是( )
| A. | 按系统命名法,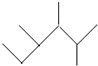 的名称为2,3-二甲基-4-乙基庚烷 的名称为2,3-二甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到乙烯,煤液化可得到煤焦油、粗氨水、粗苯等液体 | |
| D. | 1molHC≡CCHO最多能与3mol H2完全反应 |
18.下列离子方程式正确的是( )
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+H+═HCO3ˉ | |
| C. | 大理石中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | MgC12溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
5.一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol•L-1的下列6种溶液的pH:
(1)①请根据上述信息判断下列反应不能发生的是CE(填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
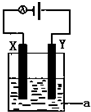 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1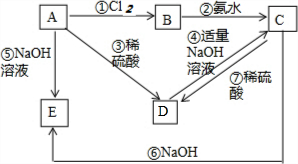 已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)
已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)