题目内容
8.运用铁及其化合物的知识,完成下列各题.(1)下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是B.
A.盐酸 B.氯气 C.CuSO4溶液 D.稀硫酸
(2)把过量的铁粉加入稀硝酸中,其结果是C.
A.不反应 B.生成硝酸铁 C.生成硝酸亚铁
(3)要除去FeCl2溶液中的少量FeCl3,可行的办法是D.
A.滴入KSCN溶液 B.通入氯气 C.加入铜粉 D.加入铁粉.
分析 (1)能跟KSCN溶液作用生成红色溶液,则与Fe反应的生成物中含三价铁;
(2)过量的铁粉与稀硝酸反应生成硝酸亚铁、NO和水;
(3)要除去FeCl2溶液中的少量FeCl3,应加入铁粉后过滤.
解答 解:(1)能跟KSCN溶液作用生成红色溶液,则与Fe反应的生成物中含三价铁,只有氯气与Fe反应符合,故选:B;
(2)过量的铁粉与稀硝酸反应生成硝酸亚铁、NO和水,故选:C;
(3)要除去FeCl2溶液中的少量FeCl3,应加入铁粉后过滤,故选:D.
点评 本题考查铁的化学性质,为高频考点,涉及离子检验、氧化还原反应、除杂等,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
18.下列设计的实验方案能达到相应实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| D | 证明氯化银的溶解度大于硫化银的溶解度 | 向2mL0.1mol•L-1硝酸银溶液中加入1mL0.1mol•L-1NaC1溶液,出现白色沉淀,再加入几滴0.1mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
19.下列实验操作、实验现象和实验结论均正确的是( )
| A. | 在含有Fe3+的NaCl溶液中加入适量NaOH溶液,过滤,可除去杂质 | |
| B. | 将含有杂质HC1的Cl2通入饱和食盐水中,可收集到纯净的Cl2 | |
| C. | 某粉末中滴加盐酸,产生能使澄清石灰水变浑池的无色无味气体该粉末为碳酸盐 | |
| D. | 向某溶液中滴加酸化的Ba(NO3)2溶液,出现白色沉淀,则该溶液中含有SO42- |
16.下列离子方程式中,正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氧化铝与稀硫酸反应Al2O3+6H+═2Al3++3H2O | |
| C. | 氢氧化铝与稀硝酸反应OH-+H+═H2O | |
| D. | 铜与稀硝酸反应:Cu+2H++2NO3-═Cu2++2NO↑+H2O |
3.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )


| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=1 | |
| C. | 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 | |
| D. | 200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5 |
13.如图为锌铜原电池装置示意图,下列说法不正确的是( )
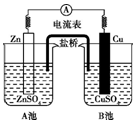

| A. | 电子由Zn极流向Cu极 | B. | 此装置能将电能转变为化学能 | ||
| C. | 取出盐桥,电流表指针不再偏转 | D. | 该装置的总反应:Zn+Cu2+═Zn2++Cu |
2.下列说法中正确的是( )
| A. | 1s22s12p1表示的是激发态原子的电子排布 | |
| B. | 3p2表示3p能级有两个轨道 | |
| C. | 同一原子中,3d轨道的能量小于4s轨道的能量 | |
| D. | 同一原子中,2p、3p、4p电子的能量逐渐减小 |
20.在给定条件下,下列选项中所示的物质间转化都能一步实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$→_{点燃}^{CO_{2}}$Na2CO3 | |
| B. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{盐酸}{→}$AlCl3 | |
| D. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
 PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )
PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )