题目内容
18.在含2mol H2SO4的浓硫酸中加入足量的Zn粉,使其充分反应,则下列推断中正确的是( )①放出的气体除了SO2外,还有H2;
②只放出了SO2气体,其物质的量为1mol;
③反应结束时产生气体的物质的量一定小于2mol;
④在反应中硫酸全部起氧化性作用;
⑤转移电子为2NA.
| A. | ①③ | B. | ①③④ | C. | ②③ | D. | ②④⑤ |
分析 浓硫酸具有强的氧化性和酸性,在含2mol H2SO4的浓硫酸中加入足量的Zn粉,先发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,所在反应的进行,浓硫酸浓度降低,变为稀硫酸,稀硫酸与锌反应生成硫酸锌和氢气,化学方程式:Zn+H2SO4=ZnSO4+H2↑,据此解答.
解答 解:浓硫酸具有强的氧化性和酸性,在含2mol H2SO4的浓硫酸中加入足量的Zn粉,先发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,所在反应的进行,浓硫酸浓度降低,变为稀硫酸,稀硫酸与锌反应生成硫酸锌和氢气,化学方程式:Zn+H2SO4=ZnSO4+H2↑,
①足量锌与浓硫酸开始反应放出的气体SO2,一段时间后,浓硫酸变为稀硫酸,反应生成H2,故正确;
②放出的气体除了SO2外,还有H2,故错误;
③浓硫酸与锌反应方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,与稀硫酸反应方程式:Zn+H2SO4=ZnSO4+H2↑,依据方程式可知:2mol浓硫酸与足量锌反应生成气体物质的量一定小于2mol,故正确;
④依据方程式浓硫酸与锌反应方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,与稀硫酸反应方程式:Zn+H2SO4=ZnSO4+H2↑,反应生成硫酸锌,体现硫酸的酸性,故错误;
⑤2 mol H2SO4反应完全,若只发生反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,2 mol H2SO4转移2 mol电子,若只发生反应Zn+H2SO4(稀)=ZnSO4+H2↑,2 mol H2SO4转移4mol电子,所以反应中转移电子数应为2NA~4NA,故错误;
故选:A.
点评 本题考查了浓硫酸的性质,明确锌与浓硫酸、稀硫酸反应的实质是解题关键,题目难度不大.

 口算题天天练系列答案
口算题天天练系列答案| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| A. | 石油分馏实验 | B. | 乙醇脱水实验 | C. | 制溴苯 | D. | 苯的硝化实验 |
| A. | 充电时电池反应为FePO4+Li═LiFePO4 | |
| B. | 充电时动力电池上标注“+”的电极应与外接电源的负极相连 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 放电时,在正极上是Li+得电子被还原 |
| A. | Fe(OH)3 | B. | CaSiO3 | C. | Al(OH)3 | D. | NaHCO3 |
| A. | 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA | |
| B. | 0.1 mol•L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA | |
| C. | 足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA | |
| D. | 常温常压下,1.6g甲烷中含有的碳原子数为0.1NA |
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,28 g CO、C2H4混合气体与22.4 L N2所含有的分子数都是NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
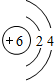 ;X元素基态原子的电子排布式为1s22s22p63s23p5.
;X元素基态原子的电子排布式为1s22s22p63s23p5.